
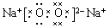 .
. 分析 A、B、C、D、E、F、G是原子序数依次增大的短周期元素,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,最高价氧化物对应水化物只有氢氧化铝能与酸、碱反应,故其中一种为氢氧化铝,另外为强酸与强碱,短周期内,强碱为氢氧化钠,原子序数E、F、G是原子序数依次增大,故E为Na元素,F为Al元素,G为S元素或Cl元素;A与B、C、D可分别形成10电子分子,A与E同主族,则A为H元素;D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,则D、G的原子序数中为2(1+11)=24,故D为O元素,G为S元素;B、C、D原子序数依次增大,都能与氢元素形成10电子分子,则B为碳元素,C为N元素,据此解答.
解答 解:A、B、C、D、E、F、G是原子序数依次增大的短周期元素,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,最高价氧化物对应水化物只有氢氧化铝能与酸、碱反应,故其中一种为氢氧化铝,另外为强酸与强碱,短周期内,强碱为氢氧化钠,原子序数E、F、G是原子序数依次增大,故E为Na元素,F为Al元素,G为S元素或Cl元素;A与B、C、D可分别形成10电子分子,A与E同主族,则A为H元素;D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,则D、G的原子序数中为2(1+11)=24,故D为O元素,G为S元素;B、C、D原子序数依次增大,都能与氢元素形成10电子分子,则B为碳元素,C为N元素.
(1)由上述分析可知,B为碳元素,处于周期表中第二周期第ⅣA族,
故答案为:第二周期第ⅣA族;
(2)上述元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是H2SO4,E、F元素最高价氧化物对应水化物分别为NaOH、Al(OH)3,二者反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:H2SO4;Al(OH)3+OH-=AlO2-+2H2O;
(3)Na在O2中燃烧生成化合物X为Na2O2,则X的电子式是: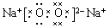 ,
,
故答案为: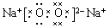 .
.
点评 本题考查结构性质位置关系应用,推断元素指关键,突破口为E、F、G元素最高价氧化物对应水化物之间可相互发生反应及A与B、C、D可分别形成10电子分子.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数约为16NA | |
| B. | 1mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,1L庚烷所含有的分子数为$\frac{{N}_{A}}{22.4}$ | |
| D. | 26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物分子中C、H、O原子个数比为1:2:3 | |
| B. | 该有机物中必定含有氧元素 | |
| C. | 该有机物分子中C、H原子个数比为1:2 | |
| D. | 该有机物化学式为C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可以使Br2水褪色,是因为SO2具有漂白性 | |
| B. | Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | Fe在Cl2中燃烧生成FeCl3,故Fe与I2反应生成FeI3 | |
| D. | 可以用铝制的容器储存和运输浓硝酸是因为常温下铝遇到浓硝酸钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素R位于周期表中第ⅤA族 | |
| B. | R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1mol RO3-参与该反应,则转移的电子的物质的量为5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子不能透过滤纸 | B. | 具有丁达尔效应 | ||
| C. | 分散质很快就沉降下来 | D. | 所得分散系是溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com