
【题目】下列可以证明2HI(g)![]() H2(g)+I2(g)已达平衡状态的是( )
H2(g)+I2(g)已达平衡状态的是( )
①单位时间内生成nmolH2的同时生成nmolHI
②一个H—H键断裂的同时有两个H—I键断裂
③温度和体积一定时,混合气体密度不再变化
④v(H2)=v(I2)=0.5v(HI)
⑤c(HI):c(H2):c(I2)=2:1:1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和压强一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
A. ②③④⑤⑥B. ②⑥⑦⑧⑨
C. ①②⑥⑧D. ②⑥⑨
【答案】D
【解析】
①单位时间内生成nmolH2的同时生成nmolHI,说明正反应速率大于逆反应速率,反应未达到平衡;
②H—H键断表示逆反应反向,H—I键断裂表示正反应方向,一个H—H键断裂的同时有两个H—I键断裂,表示正逆反应速率相等,可以说明反应达到平衡;
③温度和体积一定时,反应前后的体积不变,所以混合气体密度始终不变,所以不能说明反应达到平衡;
④v(H2)=v(I2)=0.5v(HI),没有说明反应的方向,故不能说明反应达到平衡;
⑤c(HI):c(H2):c(I2)=2:1:1,不能说明反应物或生成物浓度不再变化,不能说明反应达到平衡;
⑥温度和体积一定时,某一生成物浓度不再变化,说明某物质的生成速率等于其消耗速率,也就是正反应速率等于逆反应速率,能说明反应达到平衡;
⑦温度和体积一定时,反应前后气体体积不变,所以压强始终不变,故压强不变时,不能说明反应达到平衡;
⑧温度和压强一定时,反应前后气体的总物质的量不变,根据质量守恒,混合气体的平均相对分子质量始终不变,故混合气体的平均相对分子质量不再变化不能说明反应达到平衡;
⑨温度和体积一定时,混合气体中只有I2有颜色,所以颜色不变说明物质浓度不变,能说明反应达到平衡,
故选D。


科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 乙酸乙酯与稀硫酸共热、搅拌 | 液体不再分层 | 乙酸乙酯在酸性条件下完全水解成可溶性物质 |
B | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液 | 生成白色沉淀 | 蛋白质发生了变性 |
C | 淀粉在稀硫酸的作用下水解后,加入新制Cu(OH)2后加热 | 有砖红色沉淀生成 | 淀粉已经完全水解 |
D | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示两种晶体的微观结构:
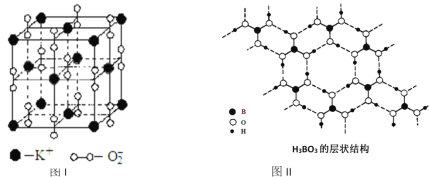
试回答下列有关问题:
(1)高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。图I为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则晶体中,与每个K+距离最近的K+有_________个,0价氧原子与-2价氧原子的数目比为_________;
(2)正硼酸(H3BO3)是一种片层结构的白色晶体,层内的H3BO3分子通过氢键相连(如图II)。下列有关说法正确的有_________。
①正硼酸晶体属于原子晶体
②H3BO3分子的稳定性与氢键有关
③在H3BO3分子中各原子未能都满足8e-稳定结构
④含1molH3BO3的晶体中有3mol氢键
⑤含1molH3BO3的晶体中有3mol极性共价键
⑥晶体中每个B与相邻的3个O共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.按系统命名法,化合物![]() 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段 的高聚物,其单体是苯酚和甲醛
的高聚物,其单体是苯酚和甲醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl和 NaOH 反应的中和热 H=-57.3kJ·mol-1,则H2SO4 和 Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
B.CO(g)的燃烧热是 283.0kJ·mol-1 则 2CO2(g)=2CO(g)+O2(g)反应的ΔH=+(2×283.0 )kJ·mol-1
C.反应物的总能量低于生成物的总能量时,反应一定不能自发进行
D.一定的温度和一定的压强下,将 0.5molN2 和1.5molH2 置于密闭容器中充分反应,放热19.3kJ,热化学方程式为 N2+3H2![]() 2NH3 ΔH=-38.6kJ·mol-1
2NH3 ΔH=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生活离不开化学知识,下列叙述正确的是( )
A.双氧水、高锰酸钾溶液可以完全灭活埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同
B.用乙醚从黄花蒿中提取青蒿素是利用了氧化还原反应原理
C.在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭
D.钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.工业上在高温条件下用铁和氧化铝制取金属铝
B.向新制氯水中加入少量碳酸钙粉末,能增强溶液的漂白性
C.纳米铁粉可以去除被污染水体中的Pb2+、Cu2+、Hg2+,利用了其还原性
D.硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
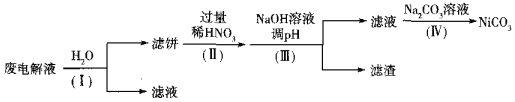
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子,分别取样,
离子,分别取样,![]() 测得溶液显弱碱性;
测得溶液显弱碱性;![]() 加入足量盐酸,有无色无味气体产生。为确定溶液组成,还需要检测的离子是
加入足量盐酸,有无色无味气体产生。为确定溶液组成,还需要检测的离子是![]()
![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com