
| A. | 原子半径逐渐增大 | B. | 碱性逐渐减弱 | ||
| C. | 单质熔、沸点逐渐升高 | D. | 单质的氧化性逐渐增强 |
分析 A.同主族元素从上到下原子电子层半径依次增多;
B.金属性越强,最高价氧化物对应水化物碱性越强;
C.金属原子半径越大,金属键越弱,熔沸点越低;
D.元素金属性越强,金属阳离子氧化性越弱.
解答 解:A.碱金属同主族,从上到下,电子层增大,原子半径依次增大,故A正确;
B.从上到下,碱金属金属性依次增强,最高价氧化物对应水化物的碱性依次增强,故B错误;
C.碱金属,从上到下,原子半径依次增大,金属键依次减弱,熔沸点依次降低,故C错误;
D.碱金属从上到下元素金属性依次增强,金属阳离子氧化性依次越弱,故D错误;
故选:A.
点评 本题考查了碱金属性质,明确同主族元素性质递变规律是解题关键,题目难度不大,注意金属晶体熔沸点规律.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某元素的原子最外层电子数是次外层电子数的两倍,该元素是碳;它在元素周期表中的位置是第二周期第ⅣA族;该元素和氢元素组成的某种有机物是“西气东输”中“气”的主要成分,这种有机物的电子式为
某元素的原子最外层电子数是次外层电子数的两倍,该元素是碳;它在元素周期表中的位置是第二周期第ⅣA族;该元素和氢元素组成的某种有机物是“西气东输”中“气”的主要成分,这种有机物的电子式为 ;结构式
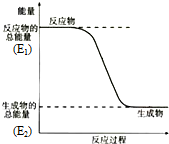
;结构式 ;空间构型:正四面体.这种化合物中碳元素的质量分数为75%.该物质在氧气中充分燃烧的反应方程式:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填写“>”或者“<”),该反应放热(填写“放出”或者“吸收”)能量.该物质与Cl2反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl(只写出第一步反应),该反应类型为取代反应.
;空间构型:正四面体.这种化合物中碳元素的质量分数为75%.该物质在氧气中充分燃烧的反应方程式:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填写“>”或者“<”),该反应放热(填写“放出”或者“吸收”)能量.该物质与Cl2反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl(只写出第一步反应),该反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.009 mol/(L•s) | B. | 0.006mol/(L•s) | C. | 0.045mol/(L•s) | D. | 0.003mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丙烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 丙烷与氯气在光照的条件下发生取代反应生成一氯代物的反应 | |
| D. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)| 操作 | 现象和结论 |
| ①取一定量2mol/LNaCl溶液,调节溶液pH为4.91;再以相同装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液, 滴入淀粉KI溶液. | 若溶液不变蓝,证明猜想①不成立 若溶液变蓝,证明猜想①可能成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度( T ) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com