


科目:高中化学 来源: 题型:阅读理解
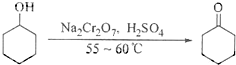
| 物质 | 沸点(℃) | 密度(g-cm-3,200C) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
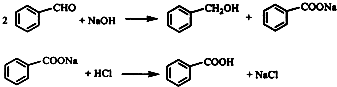
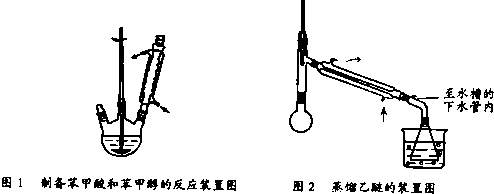


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源:2013届浙江省绍兴一中分校高三10月学习质量诊断化学试卷(带解析) 题型:实验题
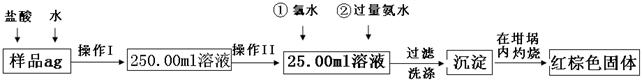
(12分)某氧化铁样品中含有少量的FeCl2杂质。现要测定其中铁元素的质量分数,按以下步骤进行实验:
请根据图的流程,回答下列问题:
⑴操作I的目的为配制250.00ml样品溶液,则所用到玻璃仪器除烧杯、玻璃棒、胶头滴管以外,还必须有 (填仪器名称);操作II必须用到的仪器是 。(填字母)
| A.50ml烧杯 | B.50ml量筒 | C.100ml量筒 | D.25ml滴定管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com