
| A. | 由于氧化性Fe3+>H+,故反应先不产生气体后产生气体 | |
| B. | 反应后产生13.44LH2(标准状况) | |
| C. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol | |
| D. | 反应后溶液中Fe3+物质的量为0.8mol |
分析 溶液中n(Fe3+)=0.2mol,n(NO3-)=0.6mol,n(H+)=3mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,由于氧化性为氧化性为HNO3>Fe3+>H+,先发生:Fe+4H++NO3-═Fe3++NO↑+2H2O,0.6molNO3-完全反应消耗0.6molFe,消耗2.4molH+,生成0.6molFe3+、0.6molNO,反应后剩余0.1molFe、0.6molH+,此时溶液中共有0.8molFe3+,再发生:Fe+2Fe3+═3Fe2+,0.1molFe反应消耗0.2molFe3+,生成0.3molFe2+,剩余0.6molFe3+,没有Fe剩余,不发生反应:Fe+2H+═Fe2++H2↑.
解答 解:溶液中n(Fe3+)=0.2mol,n(NO3-)=0.6mol,n(H+)=3mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,由于氧化性为氧化性为HNO3>Fe3+>H+,先发生:Fe+4H++NO3-═Fe3++NO↑+2H2O,0.6molNO3-完全反应消耗0.6molFe,消耗2.4molH+,生成0.6molFe3+、0.6molNO,反应后剩余0.1molFe、0.6molH+,此时溶液中共有0.8molFe3+,再发生:Fe+2Fe3+═3Fe2+,0.1molFe反应消耗0.2molFe3+,生成0.3molFe2+,剩余0.6molFe3+,没有Fe剩余,不发生反应:Fe+2H+═Fe2++H2↑.
A.由于氧化性为氧化性为HNO3>Fe3+>H+,先发生:Fe+4H++NO3-═Fe3++NO↑+2H2O,开始有气体生成,故A错误;
B.由上述分析可知,不发生反应:Fe+2H+═Fe2++H2↑.没有氢气生成,标况下生成的NO为0.6mol×22.4L/mol=13.44L,故B错误;
C.反应后溶液中存在0.6molFe3+、0.3molFe2+,反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol,故C正确;
D.反应后溶液中Fe3+物质的量为0.6mol,故D错误,
故选:C.
点评 本题考查混合物计算,关键是明确发生反应的先后顺序,再结合过量计算解答,难度中等.


科目:高中化学 来源: 题型:解答题
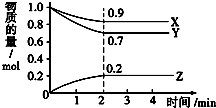 某温度时,在2L密闭容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目
,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
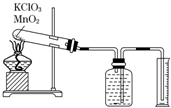 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:填空题
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题。
I.对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ==2xCO2+N2
当转移电子物质的量为0.8x mol时,该反应生成 LN2(标准状况下)。
II.一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g)  CH3OH(g) △H<0
CH3OH(g) △H<0
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入2 mol CO和6 mol H2
(2)一定条件下,CO与H2可合成甲烷,反应方程式为CO(g)+3H2(g) CH4 (g)+H2O(g)
CH4 (g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是 。
②已知H2(g)、CO(g)、和CH4 (g)的燃烧△H分别等于aKJ/mol和cKJ/mol,写出CO与H2反应生成CH4和CO2的热化学方程式: 。
(3)甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
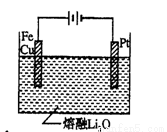
(4)CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com