
| A. | 常用热的纯碱溶液清洗餐具上的油污 | |
| B. | “84”消毒液能漂白有色物质 | |
| C. | 常用消石灰改良酸性土壤 | |
| D. | 明矾、硫酸铁常用于净水 |
分析 A.用热的纯碱溶液清洗餐具上的油污,是利用纯碱与油污发生了化学反应,而被清洗掉;
B.84消毒液溶液中次氯酸根离子水解生成次氯酸具有漂白性;
C.酸性土壤一般用碱性物质来中和.选择碱性物质时还要综合考虑这种物质的性质,如是否具有很强的腐蚀性等;
D.明矾电离的铝离子在溶液中发生水解,生成氢氧化铝能够净水;硫酸铁电离的铁离子在溶液中发生水解,生成氢氧化铁能够净水;
解答 解:A.碳酸钠溶液中碳酸根离子水解溶液显碱性,油脂在碱中水解生成易溶于水的物质易于洗涤,与水解有关,故A不选;
B.84消毒液溶液中次氯酸根离子水解生成次氯酸具有漂白性,能漂白有色物质,与水解有关,故B不选;
C.消石灰的主要成分是氢氧化钙,是一种碱性的物质.可用于中和酸性土壤改良土壤结构.故C选;
D.明矾电离的铝离子发生水解,Al3++3H2O?Al(OH)3(胶体)+3H+,生成了氢氧化铝胶体,氢氧化铝胶体具有较大的接触面积,具有吸附性,所以可用作净水剂,硫酸铁电离的铁离子发生水解,Fe3++3H2O?Fe(OH)3(胶体)+3H+,生成了氢氧化铁胶体,氢氧化铁胶体具有较大的接触面积,具有吸附性,所以可用作净水剂,与水解有关,故D不选;
故选C.
点评 本题主要考查了盐类水解的原理分析,主要是净水剂的净水原理以及物质的基本性质,题目难度中等,注意基础知识的积累.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

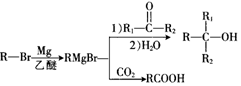
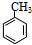 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$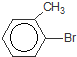 +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应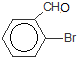
 ,H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为
,H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为
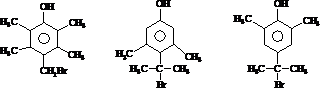
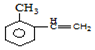 )的路线流程图(其他试剂任选)
)的路线流程图(其他试剂任选)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
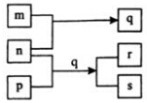 元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法错误的是( )
元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径的大小W<X<Z | B. | W的氧化物常温常压下为液态 | ||
| C. | Y的氧化物可能呈黑色或红棕色 | D. | Z的氧化物的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>X | B. | 原子序数:Y>X | ||
| C. | 电子层数:Y>X | D. | 最外层电子数:Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
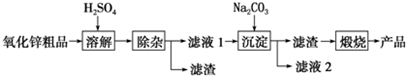
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(4x-y) kJ•mol | |
| B. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(2x-y) kJ•mol-1 | |
| C. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(2y-x) kJ•mol | |
| D. | 2SO2(g)+2KOH (l)═2KHSO3 (l)△H=-(8x-2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
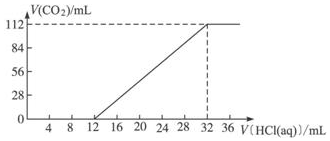 ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.
ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com