
【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
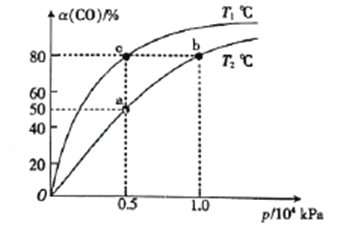
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。
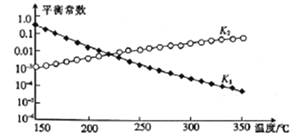
则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。
【答案】 C2H5OH(g)+3O2(g) 2CO2(g)+3H2O(g) △H=-1253 kJmol-1 > < 温度低于240℃时,反应速率较慢,同时该反应为放热反应,温度高于270℃时,化学平衡逆向移动,转化率降低 K(a)=K(b)<K(c) < 由图可知,随着温度升高,K1减小,则△H1<0,K2增大,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3
【解析】(1)已知反应 C2H5OH(g)+3O2(g)![]() 2CO2(g)+3H2O(g) 的△H=反应物的键能和-生成物的键能和=(413×5+348×1+351×1+463×1+498×3) kJmol-1 -(799×4+463×6) kJmol-1=-1253 kJmol-1,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为C2H5OH(g)+3O2(g)
2CO2(g)+3H2O(g) 的△H=反应物的键能和-生成物的键能和=(413×5+348×1+351×1+463×1+498×3) kJmol-1 -(799×4+463×6) kJmol-1=-1253 kJmol-1,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为C2H5OH(g)+3O2(g)![]() 2CO2(g)+3H2O(g) △H=-1253 kJmol-1 ;
2CO2(g)+3H2O(g) △H=-1253 kJmol-1 ;
(2)①温度相同时,压强越大反应速率越快,则a、b两点的反位速率:v(b)>v(a);
②压强相同时,温度越高达到平衡所需要的时间越短,则T1<T2;
③温度低于240℃时,反应速率较慢,同时该反应为放热反应,温度高于270℃时,化学平衡逆向移动,转化率降低,再结合催化剂活性,比反应的温度一般控制在240~270℃;
④图中a、b两点温度不变,平衡常数不变,即K(a)=K(b),升高温度平衡逆向移动,平衡常数减小,则K(a)=K(b)<K(c);
(3)由图可知,随着温度升高,K1减小,则△H1<0,K2增大,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3。


科目:高中化学 来源: 题型:
【题目】关于O2和SO2两种气体的叙述,正确的是( )
A.两者质量相等时,其分子数相等
B.两者质量相等时,其原子数相等
C.同温同压时,两者密度之比为1∶2
D.同温同压时,同体积气体所含原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中加入NaOH溶液先生成白色沉淀,沉淀迅速变灰绿色,最终变红褐色的是
A. FeSO4 B. MgSO4 C. A12(SO4)3 D. Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质结构的说法正确的是
A. 有共价键存在的物质熔沸点一定很高
B. 液氯与水反应破坏了分子间作用力和共价键
C. 离子化合物中一定含有离子键、一定不含共价键
D. 晶体NH4Cl和Na2O中的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用人工光合作用合成甲酸的原理为2CO2+2H2O![]() 2HCOOH+O2,,装置如下图所示,下列说法不正确的是
2HCOOH+O2,,装置如下图所示,下列说法不正确的是
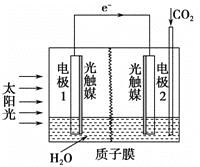
A. 该装置将太阳能转化为化学能和电能
B. 电极1周围pH减小
C. 电极2上发生的反应为CO2+2H++2e-=HCOOH
D. H+由电极2室经过质子膜流向电极1室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成元素氮、碳、硅非金属性强弱比较的实验研究。已知A是强酸,B是块状固体;打开分液漏斗的活塞后,可看到有大量气泡产生;烧杯中可观察到白色沉淀生成。
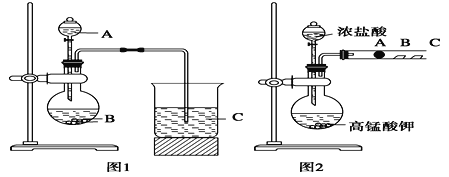
(1)写出选用的物质:A_________,B_________,C_________(填化学式);
(2)乙同学认为甲同学设计的实验不够严谨,应该在B和C之间增加一个洗气装置,该装置中应盛放___________。(填试剂)
(3)烧杯中反应的离子方程式为___________________________________。
(4)丙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr 溶液的棉花、湿润淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。A处的实验现象为:_____________;写出B处反应的离子方程式___________。
(5)丙同学的实验不能充分证明氧化性:Cl2>Br2>I2,理由是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.按系统命名法,![]() 的名称为2,7,7-三甲基-3-乙基辛烷
的名称为2,7,7-三甲基-3-乙基辛烷
B.实验证实![]() 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键
可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键
C. DDT的结构简式为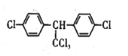 ,分子中最多有14个碳原子共平面
,分子中最多有14个碳原子共平面
D. 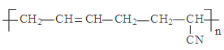 的单体是CH3-C≡C-CH3和CH2=CH-CN
的单体是CH3-C≡C-CH3和CH2=CH-CN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将乙醇滴入热的浓硫酸中,发生反应:C2H5OH +6H2SO4 = 6SO2↑+2CO2↑+9H2O,浓硫酸没有体现的性质是
A. 氧化性 B. 脱水性 C. 酸性 D. 吸水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积可变的容器中发生反应N2+3H22NH3,当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是
A. 分子运动速率加快,使反应物分子间的碰撞机会增多
B. 反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C. 活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多
D. 分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com