
【题目】下列说法正确的是
A. 0.1 mol H2中含有的分子数为6.02×1022
B. 24 g Mg变成Mg2+时失去的电子数为6.02×1023
C. 1 L 1 mol·L-1 CaCl2溶液中含有的Cl-数为6.02×1023
D. 常温常压下,11.2 L O2中含有的原子数为6.02×1023
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下,11.2L HF含有的分子数目为0.5NA
B. 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
C. 常温下,0.2 L 0.5 mol·L-1 NH4NO3溶液中含有的氮原子数小于0.2NA
D. 18g葡萄糖(C6H12O6)分子含有的羟基数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol/L。下列判断错误的是( )
xC(g)+2D(g)。2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol/L。下列判断错误的是( )
A. x=1 B. 2 min内A的反应速率为0.3 mol·L-1·min-1
C. B的转化率为40% D. 若混合气体的密度不变则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为_______________。
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.定量实验方案如下(部分装置和操作略):

(3)仪器A的名称是________________。
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为______________。
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定, 除去H2O2的方法是__________。
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为__________g/L。该测定结果比实际值偏高,分析原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下:

根据以上信息和相关知识判断,下列分析不正确的是
A.该“84消毒液”的物质的量浓度约为4.0mol·L-1
B.一瓶该“84消毒液”能吸收空气中44.8L的CO2(标准状况)而完全变质
C.取100mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04mol·L-1
D.参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含25% NaClO的消毒液,需要称量的NaClO固体质量为149g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用下列装置制取纯净FeCl3固体。其中A是Cl2的发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网,F为干燥的空广口瓶,烧杯G为尾气吸收装置。

试回答:
(1)该装置中有一明显错误是____________(填字母)。
(2)D中所装试剂为_____________,C装置的作用是___________________。
(3)A中发生反应的化学方程式是__________________,G中发生反应的离子方程式是________________。
(4)若用100mL 12mol/L盐酸与足量MnO2充分反应,生成的Cl2体积(标准状况)________(填“大于”“小于”或“等于”)6.72 L。
(5)用所制取的FeCl3固体制成Fe(OH)3胶体,区分胶体和溶液常用________,分离胶体和溶液常用的方法叫_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂排放的污水中含有FeSO4、CuSO4两种物质。甲、乙、丙三位学生分别设计了从该污水中回收纯净金属铜的方案(如图所示)。

(1)甲、乙、丙提出的实验方案能否得到纯净的金属铜?
甲___,乙___,丙___。(填“能”或“不能”)
(2)在丙同学进行的“酸溶”操作中,加入的酸是___(填“稀盐酸”或“稀硫酸“)。合并的滤液中的主要溶质是___。
(3)丙同学的方案中,过程①加入过量的铁粉时发生反应的化学方程式为___。
(4)操作一、二、三的名称是___,该操作中需使用的玻璃仪器有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
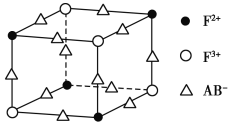
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子。
(1)基态的F3+核外电子排布式是____________________________________________。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是______________。
(3)化合物FD3是棕色固体、易潮解、100 ℃左右时升华,它的晶体类型是______________;化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是____________________。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是______________________________________________________________。
(5)化合物EF[F(AB)6]是一种蓝色晶体,下图表示其晶胞的![]() (E+未画出)。该蓝色晶体的一个晶胞中E+的个数为________。
(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要450mL 1mol/L的硫酸,现用密度为1.84g/㎝3,溶质的质量分数98%的浓硫酸来配制,有关说法正确的是(设NA阿伏加德罗常数的值)
A. 配制溶液时需的仪器只需要500mL容量瓶、烧杯、玻璃棒、量筒
B. 配制溶液定容时,仰视读数会使溶液的实际浓度偏大
C. 65克单质锌与一定量的该浓硫酸完全反应,生成的气体质量可能为32克
D. 配制该溶液所需浓硫酸体积为24mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com