
甲烷燃料电池,分别选择H2SO4溶液和NaOH溶液做电解质溶液,下列有关说法正确的是
A.总反应式都为CH4+2O2 === CO2+2H2O
B.H2SO4和NaOH的物质的量都不变,但浓度都减小
C.若用H2SO4溶液做电解质溶液,负极反应式为CH4-4e-+H2O===CO2+4H+
D.若用NaOH溶液做电解质溶液,正极反应式为O2+2H2O+4e-===4OH-
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
A、B、C是核电荷数1~18元素的原子,具有相同的电子层数,而且B的核电荷数比A大2,C的质子数比B多4,1 mol A与水反应生成1 g H2,这时A转化成Ne的电子层结构。
(1)A的元素名称为________。
(2)B离子的结构示意图为_______________________________。
(3)C元素原子的结构示意图为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧衍生物
A.②④ B.②③
C.①③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
依据元素周期表及元素周期律,下列推测正确的是( )
A.H3BO3的酸性比H2CO3的强
B.Mg(OH)2的碱性比Be(OH)2的强
C.HCl、HBr、HI的热稳定性依次增强
D.若M+和R2-的核外电子层结构相同,则原子序数:R>M
查看答案和解析>>
科目:高中化学 来源: 题型:
化学知识在生产和生活中有着重要的应用。下列说法中,错误的是( )
A.与铜质水龙头连接处的钢质水管易发生腐蚀
B.明矾常作为净水剂,双氧水通常可用作杀菌消毒
C.催化剂可以改变反应速率,对平衡移动没有影响
D.合成氨工业中通过升高温度可以增大平衡常数K,来提高氨的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数Ksp(CaF2)=1.46×10-10 mol3·L-3。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法正确的是( )
A. 25 ℃时,0.1 mol·L-1 HF溶液的pH=1 B.Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中HF与CaCl2反应产生沉淀 D.该体系中没有沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
I.近年来全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量影响严重,这是目前重要的研究课题 。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
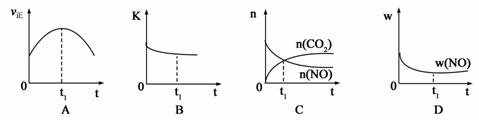
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
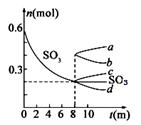 Ⅱ.利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关
Ⅱ.利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关
键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,右图表
示SO3 物质的量随时间的变化曲线。
① 达到平衡时,用SO2表示的化学反应速率为 。
② 平衡时,SO3的转化率为 (保留小数点后一位);
T1℃时,反应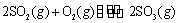 的
的
平衡常数为 ; 其他条件不变,在8min时压缩容器体积至0.5L,
则n(SO3)的变化曲线为 (填字母)。
③右表为不同温度(T)下,反应2SO2(g) + O2(g)  2SO3(g) (△H<0)
2SO3(g) (△H<0)
| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
的化学平衡常数(K),由此推知,温度最低
的是 (填“T1”、“T2” 或 “T3)
查看答案和解析>>
科目:高中化学 来源: 题型:
某校课外活动小组为探究铜与稀硝酸反应产生的气体主要是NO,设计了下列实验。图中K为止水夹,F是装有一半空气的注射器,其中加热装置和固定装置均已略去。
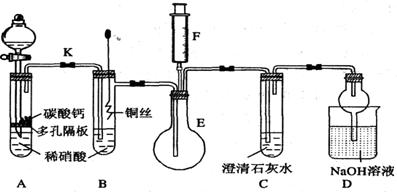
请回答有关问题:
(1)设计装置A的目的是 。
(2)在完成装置A的实验目的后,关闭K,再将装置B中的铜丝插入稀硝酸。 B中反应的离子方程式是 。
(3)将F中的空气推入E中,证明NO存在的实验现象是 ,此过程发生反应的化学方程式是 。
(4)装置D中NaOH溶液的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃烧废气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝:利用甲烷催化还原NO2:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH=-1 160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为________________
_________________________________________________________。
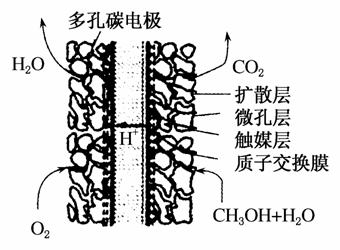
(2)某一甲醇燃料电池的结构如图所示。其工作时负极的电极反应式可表示为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com