
| A. | 1 g H2含有的氢原子数目为2NA | |
| B. | 常温常压下,22.4 L O2含有的分子数目为NA | |
| C. | 1 L 1 mol•L-1 KOH溶液中含有的钾离子数目为NA | |
| D. | 1 mol Zn变为Zn2+失去的电子数目为NA |
分析 A.质量转化为物质的量,结合氢原子为双原子分子解答;
B.常温常压下,Vm>22.4L/mol;
C.依据n=CV计算解答;
D.1个锌原子失去2个电子生成锌离子.
解答 解:A.1 g H2含有的氢原子数目为$\frac{1g}{2g/mol}$×2×NA=NA,故A错误;
B.常温常压下,Vm>22.4L/mol,则常温常压下,22.4 L O2含有的分子数目小于NA,故B错误;
C.1 L 1 mol•L-1 KOH溶液中含有的钾离子数目为1L×1mol/L×NA=NA,故C正确;
D.1 mol Zn变为Zn2+失去的电子数目为2NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意气体摩尔体积的使用条件.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸溶液中和氢氧化钠溶液 | B. | 硫酸溶液中和氢氧化钡溶液 | ||
| C. | 盐酸溶解氧化铜 | D. | 盐酸溶解氢氧化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
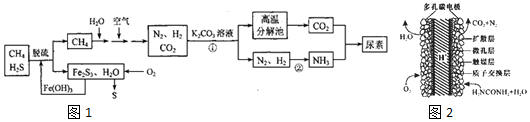
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向某溶液中加入BaCl2溶液,再加入盐酸 | 证明溶液中是否含SO42- |
| B | 加热铝箔,熔化的铝不滴落 | 铝表面的氧化膜熔点高,包在熔化的铝外面 |
| C | Cl2能使湿润的紫色石蕊试纸先变红后褪色 | Cl2具有漂白性 |
| D | 将SO2通入品红溶液中,品红溶液褪色,加热褪色后的品红溶液,溶液恢复红色 | 验证亚硫酸的不稳定性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
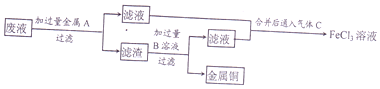
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入CuSO4溶液中 | B. | 过量的NaOH溶液和明矾溶液反应 | ||
| C. | 金属钠投入MgSO4溶液中 | D. | 金属铝投入NaOH溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com