

分析 Ⅰ.若W遇淀粉溶液变蓝,w是碘单质,X和Y反应生成碘和Z,Z是生活中常用的调味品,Z是氯化钠,根据元素守恒、氧化还原反应及X和W是单质、Y和Z为化合物知,X是氯气,Y是碘化钠;
Ⅱ.若X是工业上用量最大的金属单质,则X是铁,Z是一种具有磁性的黑色晶体,Z是四氧化三铁,X、Y、Z、W四种物质有如下相互转化关系,其中X、W单质,Y、Z为化合物,该反应是铁和水蒸气反应生成氢气和四氧化三铁,所以W是氢气,Y是水.
(1)高温下,铁和水蒸气反应生成四氧化三铁和氢气;
(2)①从实验安全性方面分析;
②实验过程中要防止杂质的干扰,在实验中要有除杂装置;
(3)先确定溶液中溶质成分,再根据原子守恒计算氢氧化钠的体积.
解答 解:Ⅰ.若W遇淀粉溶液变蓝,w是碘单质,X和Y反应生成碘和Z,Z是生活中常用的调味品,Z是氯化钠,根据元素守恒、氧化还原反应及X和W是单质、Y和Z为化合物知,X是氯气,Y是碘化钠;
(1)通过以上分析知,向FeCl2溶液中加入Cl2的水溶液,使溶液颜色变为棕黄色,
故答案为:Cl2;
(2)工业上用电解饱和氯化钠溶液制取氢氧化钠,电解方程式为:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2NaOH,
故答案为:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2NaOH;
(3)氯气有强氧化性,能把碘离子氧化生成碘酸根离子,同时自身被还原成氯离子,离子方程式为:3Cl2+I-+3H2O═6Cl-+IO3-+6H+,
故答案为:3Cl2+I-+3H2O═6Cl-+IO3-+6H+;
Ⅱ.若X是工业上用量最大的金属单质,则X是铁,Z是一种具有磁性的黑色晶体,Z是四氧化三铁,X、Y、Z、W四种物质有如下相互转化关系,其中X、W单质,Y、Z为化合物,该反应是铁和水蒸气反应生成氢气和四氧化三铁,所以W是氢气,Y是水.
(1)高温条件下,铁和水反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,
故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2;
(2)①氢气还原氧化物的实验中,因为氢气和氧气在一定范围内会产生爆炸,所以实验应该先制取氢气,然后检验氢气再通入氢气,通入一段时间后再点燃酒精灯,所以实验顺序为b、c、a,
故答案为:b c a;
②该反应是放热反应,盐酸检验挥发性,所以制取的氢气中含有氯化氢气体,为防止氯化氢气体干扰实验,应该在甲、乙装置中间增加一个装有水的洗气瓶,洗气氯化氢气体,
故答案为:在甲、乙装置中间增加一个装有水的洗气瓶;
(3)四氧化三铁和硝酸反应生成硝酸盐和NO,向溶液中滴加氢氧化钠溶液,硝酸盐和氢氧化钠反应生成沉淀和硝酸钠,根据溶液中硝酸根离子的量计算氢氧化钠的浓度,
硝酸的物质的量=4mol/L×0.05L=0.2mol,充分反应,产生112mL的NO,根据氮原子守恒,硝酸和一氧化氮的物质的量之比为1:1,则溶液中剩余硝酸的物质的量=0.2mol-$\frac{0.112L}{22.4L/mol}$=0.195mol,硝酸盐和氢氧化钠反应生成沉淀和硝酸钠,则氢氧化钠和硝酸根离子之间的物质的量之比为1:1,设氢氧化钠的体积为V.
NaOH------NO3-,
1mol 1mol
2V 0.195mol
V=97.5mL,
故答案为:97.5.
点评 本题以元素化合物的推断为载体考查了元素化合物的性质,明确元素化合物性质是解本题的关键,同时考查学生思维能力、分析推断能力,注意(3)题中根据原子守恒计算氢氧化钠的体积较简便,正确确定溶质即可分析解答,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 如图所示某硅氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的是( )
如图所示某硅氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的是( )| A. | 键角为120℃ | B. | 化学组成为SiO32- | ||
| C. | 键角为60° | D. | 化学组成为SiO44- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ls22s22p63s23p5 | B. | 1s22s22p63s23p2 | C. | 1s22s22p2 | D. | 1s22s22p63s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a-c=m-n | B. | b-d=m+n | C. | a>b>d>c | D. | b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色.
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色. .甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究;
.甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究; ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 现象与结论: 若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用 若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物. .
. 、
、 .
. ,试写出有关化学反应方程式:CH≡CH+HCl$→_{△}^{催化剂}$CH2=CHCl,nCH2=CHCl$\stackrel{一定条件}{→}$
,试写出有关化学反应方程式:CH≡CH+HCl$→_{△}^{催化剂}$CH2=CHCl,nCH2=CHCl$\stackrel{一定条件}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
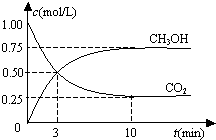 恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:| A. | 该密闭容器的体积为1 L | |
| B. | 反应达平衡,氢气的转化率为0.75 | |
| C. | 反应达平衡,氢气平均反应速率0.075 mol/(L•min) | |
| D. | CO2或H2O物质的量不再改变时反应达平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com