
分析 (1)水的电离是吸热反应,升高温度促进水电离,则溶液的离子积常数增大;
(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,
①溶液呈中性,说明酸和碱恰好完全反应,根据溶液的酸碱性及电荷守恒确定离子浓度大小;
②若所得混合液的pH=2,根据c(H+)=$\frac{c(酸)V(酸)-c(碱)V(碱)}{V(酸)+V(碱)}$计算酸碱的体积比,根据溶液的酸碱性及物料守恒判断离子浓度大小.
解答 解:(1)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,某温度(T℃)时,水的离子积常数Kw=1×10-13>10-14,则该温度大于25℃,
故答案为:大于;水的电离过程吸热,该温度下的Kw比25℃时大,所以该温度大于25℃;
(2)pH=11的NaOH溶液中氢氧根离子浓度为:c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,稀硫酸溶液中氢离子浓度为:c(H+)=0.1mol/L,则:
①若所得混合液为中性,则有:0.01a=0.1b,
解得:a:b=10:1;
混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得:c(Na+)>c(SO42- ),该溶液为盐溶液,硫酸根离子浓度大于氢离子浓度,所以离子浓度大小顺序是:c(Na+)>c(SO42-)>c(H+)=c(OH-),
故答案为:10:1; c(Na+)>c(SO42- )>c(H+)=c(OH-);
②若所得混合液的pH=2,则有:$\frac{0.1b-0.01a}{a+b}$=0.01,
解得:a:b=9:2;
溶液呈酸性,则:c(H+)>c(OH-),
溶液中氢离子浓度为0.01mol/L,硫酸根离子浓度为:$\frac{0.05×2}{2+9}$mol/L=0.009mol/L,
所以氢离子浓度大于硫酸根离子浓度,根据物料守恒知,c(SO42-)>(Na+),氢氧根离子浓度最小,
所以离子浓度大小顺序为:c(H+)>c(SO42- )>c(Na+)>c(OH-),
故答案为:9:2;c(H+)>c(SO42- )>c(Na+)>c(OH-).
点评 本题考查酸碱混合的定性判断、离子浓度大小比较,题目难度中等,注意掌握根据溶液的酸碱性及电荷守恒判断离子浓度大小的方法,注意(2)中水的离子积常数是10-13而不是10-14,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| X | Y | Z | |
| W |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.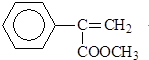 .
.
 .
.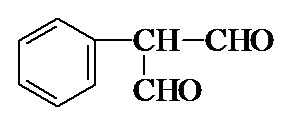 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
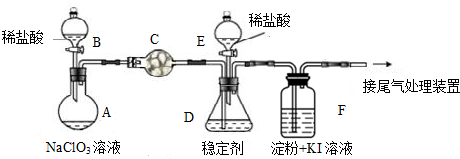
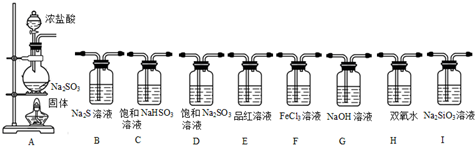
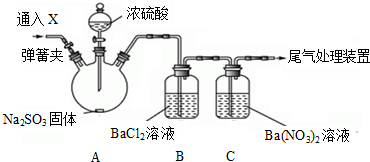

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸盛放在玻璃试剂瓶中 | |
| B. | 浓硝酸盛在棕色试剂瓶中 | |
| C. | 氢氧化钠溶液盛在带橡皮塞的玻璃瓶中 | |
| D. | 氯水盛在棕色试剂瓶中,并放置在冷暗处 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,14 g乙烯中含碳原子数为NA | |
| B. | 1 mol NH4+与1 mol OH-所含的电子数均为10NA | |
| C. | 常温常压下,22.4L CH4中含C-H键数目为4NA | |
| D. | 常温下,pH=13的NaOH溶液中含OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
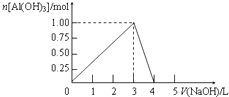 向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果正确的是( )
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果正确的是( )| A. | 反应过程中,沉淀最多时的质量为7.8g | |
| B. | AlCl3溶液的浓度为2.0 mol•L-1 | |
| C. | 得到39g沉淀时,消耗的NaOH溶液体积为1.5L或3.5L | |
| D. | 当V(NaOH)=4L时,得到的溶液中Na+、Cl-浓度相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com