
| A. | 14g由N2和13C2H2组成的混合物所含的电子数为7NA | |
| B. | 标准状况下,11.2L NO与11.2L O2混合后所含的分子数小于0.75NA | |
| C. | 常温下,1L PH=3的Al2(SO4)3溶液中,水电离出的H+数目为10-3NA | |
| D. | 在100mL 1 mol•L-5 Na2S02溶液与1.12 L(标准状况)CL2的反应中,•还原剂失电子0.2NA |
分析 A、N2和13C2H2的摩尔质量均为28g/mol,且两者中均含14个电子;
B、NO和氧气混合后生成的NO2中存在平衡:2NO2?N2O4;
C、在硫酸铝溶液中,所有的氢离子均来自于水的电离;
D、在100mL 1 mol•L-5 Na2S03溶液与1.12 L(标准状况)CL2的反应中,亚硫酸钠过量.
解答 解:A、N2和13C2H2的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,且两者中均含14个电子,故0.5mol混合物中含7NA个电子,故A正确;
B、NO和氧气混合后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减小,故分子数目小于0.75NA个,故B正确;
C、在硫酸铝溶液中,所有的氢离子均来自于水的电离,而1LpH=3的硫酸铝溶液中,氢离子的物质的量为0.001mol,故个数为0.001NA个,故C正确;
D、在100mL 1 mol•L-5 Na2S03溶液与1.12 L(标准状况)CL2的反应中,亚硫酸钠过量,氯气完全反应,而反应后变为-1价,故标况下1.12L即0.05mol氯气得0.1mol电子,则还原剂亚硫酸钠失去0.1NA个电子,故D错误.
故选ABC.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
| A. |  操作I导致配制溶液的物质的量浓度偏小 | |
| B. |  用装置II干燥氨气 | |
| C. |  实验Ⅲ可观察铁钉的吸氧腐蚀 | |
| D. |  实验Ⅳ记录的读数为12.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

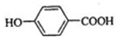 ;
; ,该反应类型为取代反应;
,该反应类型为取代反应; (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应进行60s时,X、Y、Z的浓度相等 | |
| B. | 反应进行80s时,逆反应速率大于正反应速率 | |
| C. | 以X浓度变化表示的反应速率为0.06mol/(L•min) | |
| D. | 反应进行80s时,Y物质的量浓度为0.03mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(标准状况) |
| ③ | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g;第二次称量读数为2.33g |
| 阴离子符号 | 物质的量浓度/mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2只作氧化剂 | |
| B. | 2 mol FeSO4发生反应时,反应中共有8 mol电子转移 | |
| C. | 每生成16g氧气就有1mol Fe2+ 被还原 | |
| D. | Na2FeO4既是还原产物又是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
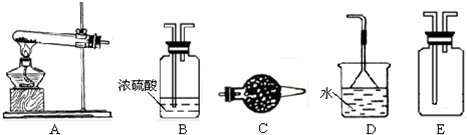
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com