
(1)原混合物中碳酸钠的物质的量。
(2)盐酸的物质的量浓度。
(1)Na2CO3 0.01 mol
(2)c(HCl)=2 mol·L-1
解析:(1)2NaHCO3====Na2CO3+CO2↑+H2O 质量减少?
168 g 62 g
m(NaHCO3) 2.74 g-2.12 g=0.62 g
m(NaHCO3)=![]() =1.68 g
=1.68 g
所以原混合物中m(Na2CO3)=2.74 g-1.68 g=1.06 g,n(Na2CO3)=![]() =0.01 mol
=0.01 mol
(2)残余固体为Na2CO3,n(Na2CO3)=![]() =0.02 mol
=0.02 mol
Na2CO3+2HCl====2NaCl+CO2↑+H2O
2 2
n(HCl)=n(Na+)=2n(Na2CO3)=0.04 mol
所以n(HCl)=![]() =2 mol·L-1
=2 mol·L-1


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:阅读理解
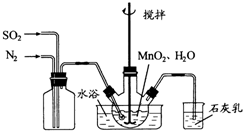 (2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下: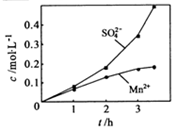
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com