
【题目】(1)将标准状况下的a L NH3(g)溶于0.1L水中,得到的氨水密度为b gcm﹣3,则该氨水的物质的量浓度是多少?(用a,b表示)
(2)已知反应:6NO + 4NH3= 5N2+ 6H2O。现有NO与NH3的混合物1mol,充分反应后所得产物中,经还原得到的N2比经氧化得到的N2多1.4g。若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量各是多少?
【答案】1000ab/(2240+17a) ;第一种情况:n(NO)=0.3mol,n(NH3)=0.7mol,第二种情况: n(NO)=0.8mol,n(NH3)=0.2mol
【解析】(1)标况下aL氨气的物质的量为:n(NH3)=![]() =
=![]() mol,氨气的质量为:m(NH3)=17g/mol×
mol,氨气的质量为:m(NH3)=17g/mol×![]() mol=
mol=![]() g,所得溶液的质量为:
g,所得溶液的质量为:![]() g+1g/mL×100mL=(
g+1g/mL×100mL=(![]() +100)g,所得溶液的物质的量浓度为:c=
+100)g,所得溶液的物质的量浓度为:c=![]() =
=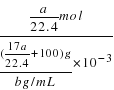 =
=![]() mol/L;
mol/L;
(2)由4NH3 + 6NO = 5N2 + 6H2O可知,NH3中的氮元素为氧化产物,NO的中的氮元素为还原产物;因为经还原得到的N2比经氧化得到的N2多1.4g。若恰好完全反应,有经还原得到的N2与经氧化得到的N2之比为3:2,设经还原得到的N2有3x mol,即有NO 3x mol,则经氧化得到的N2有2x mol,即有NH3 2x mol,所以 3x -2x = 1.4g/(28g/mol)=0.05mol,解得 x = 0.05mol,则反应的NH3有4x=0.2mol,反应的NO有6x=0.3mol。
此时NH3与NO的总物质的量为0.05mol×(4+6)=0.5mol,而现有NO和NH3的混合物1 mol,
则剩余0.5mol气体未参加反应,有两种情况:即剩余气体全为NH3或全为NO,则有NH3 0.7mol,NO 0.3mol或有NH3 0.2mol,NO 0.8mol。


科目:高中化学 来源: 题型:
【题目】下列关于元素周期表和元素周期律的说法不正确的是 ( )
A. 从氟到碘,生成的氢化物熔、沸点逐渐升高,稳定性逐渐减弱
B. 因为钠原子比铝原子容易失去电子,所以钠比铝的还原性强
C. 从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强
D. 氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在周期表中的位置关系如图:

Ⅰ.若Z元素原子的最外层电子数是电子层数的2倍
(1)W在周期表中的位置为________________。
(2)仅有Y和Z两种元素组成的两种化合物之间可以进行相互转化,写出化学方程式:___________________________________________________________。
(3)写出铜和X的最高价氧化物水化物的稀溶液反应的离子方程式:_______________________________________________________________。
(4)W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol电子转移时,共产生9 mol气体,写出该反应的化学方程式:_________________________________________________________________。
Ⅱ.若Y和Z的核外电子数之和为22。
(1)Y和H元素以原子比1∶2形成的物质的电子式为______________。
(2)将X的最高价氧化物通入到苯酚钠溶液中,实验现象是____________。
(3)X单质与W的最高价氧化物水化物的浓溶液反应,当电子转移0.4 mol时,产生气体的体积(标准状况下)是________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A. 铜和FeCl3溶液均能导电,但二者都不是电解质
B. 分解反应的生成物中一定有单质
C. 分散质粒子的直径在1×10-9cm~1×10-7cm之间的分散系属于胶体
D. 氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的描述不正确的是( )
A.SiO2可用于制造光导纤维
B.H2SiO3可以用二氧化硅和水反应制得
C.普通玻璃是以纯碱、石灰石和石英为原料制成的
D.盛装NaOH溶液的试剂瓶不用玻璃塞的原因是玻璃塞与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com