
| A. | 熔点260.7K | B. | 具有很高的比热 | C. | 可作冷却剂 | D. | 能跟水剧烈反应 |
科目:高中化学 来源: 题型:选择题
| A. | 0.5L1.2mol•L-1的Na2SO4溶液 | B. | 2L 0.8mol•L-1的Na0H溶液 | ||
| C. | 1L1mol•L-1的Na2CO3溶液 | D. | 4L 0.5mol•L-1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L由H2和O2组成的混合气体,所含分子总数为NA | |
| B. | 1mol Cl2参加反应,转移的电子数一定为2NA | |
| C. | 常温常压下,1 mol氖气含有的原子数为NA | |
| D. | 1L1 mol.L-l FeCl3溶液中Fe3+的数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
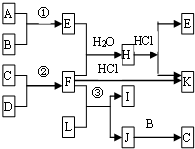 如图是部分短周期元素的单质及其化合物的转化关系图
如图是部分短周期元素的单质及其化合物的转化关系图| 溶液酸碱性 | 离子浓度大小顺序 | |
| 1 | 酸性 | |
| 2 | 中性 | |
| 3 | 碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据碳酸盐与盐酸反应能放出二氧化碳气体,确定某矿石中是否含碳酸盐 | |
| B. | 根据纤维在火焰上燃烧产生的气味,确定该纤维是否为蛋白质纤维 | |
| C. | 根据加入氯化钡溶液的方法来检验溶液中是否含有硫酸根离子 | |
| D. | 根据氨气能使湿润的红色石蕊试纸变蓝色,可以用于铵根离子的检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
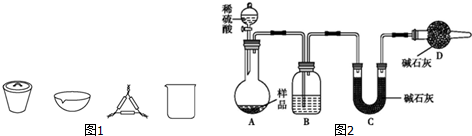
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com