
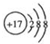 £®
£®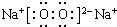 £¬øĆ²śĪļĖłŗ¬ÓŠµÄ»Æѧ¼üĄąŠĶÓŠĄė×Ó¼ü”¢·Ē¼«ŠŌ¼ü£®
£¬øĆ²śĪļĖłŗ¬ÓŠµÄ»Æѧ¼üĄąŠĶÓŠĄė×Ó¼ü”¢·Ē¼«ŠŌ¼ü£®·ÖĪö AŌ×ÓµÄ×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµē×ÓŹżµÄ3±¶£¬ŌņAŌ×ÓÓŠ2øöµē×Ó²ć£¬×īĶā²ćµē×ÓŹż6£¬¹ŹAĪŖOŌŖĖŲ£»A”¢CĶ¬Ö÷×壬ŌņCĪŖSŌŖĖŲ£¬B”¢C”¢DĶ¬ÖÜĘŚ£¬ĒŅBŹĒ¶ĢÖÜĘŚŌŖĖŲÖŠŌ×Ó°ė¾¶×ī“óµÄÖ÷×åŌŖĖŲ£¬ŌņBĪŖNaŌŖĖŲ£¬DĪŖClŌŖĖŲ£®øł¾ŻŌ×Ó½į¹¹ŅŌ¼°¶ŌÓ¦µÄµ„ÖŹ»ÆŗĻĪļµÄŠŌÖŹ½įŗĻŌŖĖŲÖÜĘŚĀɵĵŻ±ä¹ęĀÉæɽā“šøĆĢā£®
½ā“š ½ā£ŗ£Ø1£©AĪŖOŌŖĖŲ£¬Ī»ÓŚÖÜĘŚ±ķµŚ¶žÖÜĘŚµŚ VIA×壬DĪŖClŌŖĖŲ£¬¶ŌÓ¦Ąė×ÓŌ×ÓŗĖĶāÓŠ3øöµē×Ó²ć£¬×īĶā²ćµē×ÓŹżĪŖ8£¬½į¹¹Ź¾ŅāĶ¼ĪŖ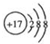 £¬
£¬
¹Ź“š°øĪŖ£ŗµŚ¶žÖÜĘŚµŚ VIA×壻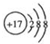 £»
£»
£Ø2£©A”¢B”¢CČżÖÖŌŖĖŲŠĪ³ÉµÄ¼ņµ„Ąė×Ó·Ö±šĪŖO2-”¢Na+”¢S2-£¬ĘäÖŠS2-±ČO2-¶ąŅ»øöµē×Ó²ć£¬ŌņĄė×Ó°ė¾¶£ŗS2-£¾O2-£¬ÓÉÓŚO2-ŗĶNa+ŗĖĶāµē×ÓÅŲ¼ĻąĶ¬£¬øł¾ŻŗĖµēŗĖŹżŌ½“󣬰ė¾¶Ō½Š”æÉÖŖ°ė¾¶O2-£¾Na+£¬ĖłŅŌĄė×Ó°ė¾¶£ŗS2-£¾O2-£¾Na+£¬¹Ź“š°øĪŖ£ŗS2-£¾O2-£¾Na+£»
£Ø3£©BĪŖNaŌŖĖŲ£¬ŌŚæÕĘųÖŠČ¼ÉÕÉś³É¹żŃõ»ÆÄĘ£¬ĪŖĄė×Ó»ÆŗĻĪļ£¬ŗ¬ÓŠĄė×Ó¼üŗĶ·Ē¼«ŠŌ¹²¼Ū¼ü£¬µē×ÓŹ½ĪŖ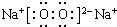 £¬
£¬
¹Ź“š°øĪŖ£ŗ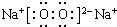 £»Ąė×Ó¼ü”¢·Ē¼«ŠŌ¼ü£»
£»Ąė×Ó¼ü”¢·Ē¼«ŠŌ¼ü£»
£Ø4£©ĀČĘųæÉÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖCl2+2OH-=Cl-+ClO-+H2O£¬¹Ź“š°øĪŖ£ŗCl2+2OH-=Cl-+ClO-+H2O£®
µćĘĄ ±¾ĢāÖ÷ŅŖæ¼²éŌŖĖŲµÄĶʶĻŅŌ¼°ŌŖĖŲ»ÆŗĻĪļÖŖŹ¶£¬ĪŖøßæ¼³£¼ūĢāŠĶ£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦µÄ漲飬½ā“š±¾ĢāŹ±×¢Ņā°ŃĪÕŌ×ӵĽį¹¹ĢŲµć£¬½įŗĻŌŖĖŲÖÜĘŚĀÉÖŖŹ¶½ųŠŠĶʶĻ£¬ÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓĆĶŠÅĢĢģĘ½³ĘČ”11.72gŹ³ŃĪ | |
| B£® | ÓĆ100mLµÄĮæĶ²ĮæČ”25.00mLŃĪĖį | |
| C£® | ÓĆpHŹŌÖ½²āµĆijĀČĖ®µÄpHĪŖ4 | |
| D£® | ÓĆ0.2000 mol/LŃĪĖįµĪ¶Ø20.00mLĪ“ÖŖÅضČNaOH£¬ÓĆČ„22.40mLŃĪĖįČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CH2=CH2+Br2 | B£® | CH2=CH-CH2-CH3+HCl | ||
| C£® | CH3-CH=CH2+H2O | D£® | nCH2=CH-CH3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ŹµŃ鱹ŗÅ | ĪĀ¶Č/”ę | ĘšŹ¼Ź±ĪļÖŹµÄĮæ/mol | Ę½ŗāŹ±ĪļÖŹµÄĮæ/mol | ||
| n£ØX£© | n£ØY£© | n£ØZ£© | n£ØY£© | ||
| ¢Ł | 600 | 1 | 0 | 0 | 0.8 |
| ¢Ś | 600 | 0.1 | a | 0.9 | 0.8 |
| ¢Ū | 600 | 0 | 1.5 | 1.5 | b |
| ¢Ü | 500 | 0.5 | 1.2 | 1.0 | c |
| A£® | ŹµŃé¢ŚĘšŹ¼Ź±V£ØÄę£©£¼v£ØÕż£©ĒŅa=0.9 | |
| B£® | 600”ꏱ£¬øĆ·“Ó¦Ę½ŗā³£ŹżK=3.2 moI/L | |
| C£® | ŹµŃé¢ŪÖŠb£¼1.2 | |
| D£® | Čōb£¾c£¬Ōņ”÷H£¼O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
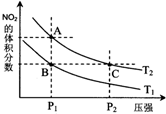 ·Ē½šŹōŌŖĖŲµŖÓŠ¶ąÖÖŃõ»ÆĪļ£¬ČēNO”¢NO2”¢N2O4µČ£®
·Ē½šŹōŌŖĖŲµŖÓŠ¶ąÖÖŃõ»ÆĪļ£¬ČēNO”¢NO2”¢N2O4µČ£®| Ź±¼ä£Øs£© | 0 | 20 | 40 | 60 | 80 |
| n£ØNO2£©/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n£ØN2O4£©/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
| t/s | 0 | 500 | 1000 |
| c£ØN2O5/mol/L£© | 5.00 | 3.50 | 2.50 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
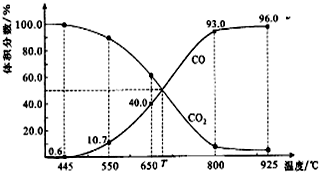
| A£® | 550”ꏱ£¬Čō³äČė¶čŠŌĘųĢ壬vÕż£¬vÄę¾ł¼õŠ”£¬Ę½ŗā²»ŅĘ¶Æ | |
| B£® | 650”ꏱ£¬·“Ó¦“ļĘ½ŗāŗóCO2µÄ×Ŗ»ÆĀŹĪŖ25.0% | |
| C£® | T”ꏱ£¬Čō³äČėµČĢå»żµÄCO2ŗĶCO£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ | |
| D£® | øĆ·“Ó¦ĪŖĪüČČ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com