
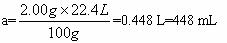
(1)甲同学取2.00 g混合物,并向其中加入过量的2.00 mol·L-1的盐酸,生成气体a mL。则a=____________(填数字),据此甲同学____________(填“能”或“不能”)计算出混合物两成分的质量比。若能,则m(CaCO3)∶m(KHCO3)=____________;若不能,此空不必作答。
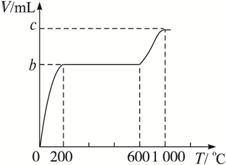
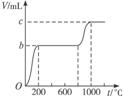
(2)乙同学称取W g混合物充分加热,所得CO2气体的体积随温度变化的曲线如图所示,则m(CaCO3)∶m(KHCO3)=____________(请用含b、c的代数式表示)。
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:

(1)甲同学称取
(2)乙同学也取
查看答案和解析>>
科目:高中化学 来源: 题型:
现有CaCO3和KHCO3的混合物,甲、乙、丙三同学分别称取一定质量的该混合物来测定其中两成分的质量比,已知K2CO3的分解温度远大于1000 ℃;气体体积均已折算成标准状况:
(1)甲同学称取2.00 g混合物,用滴定管向其中缓慢滴加2.00 mol·L-1的盐酸,当滴加到12.5 mL盐酸时不再产生气体,据此甲同学_________(填“能”或“不能”)计算出混合物两成分的质量比,若能,则m(CaCO3)∶(KHCO3)=________;若不能,此空不必做答。
(2)乙同学也取2.00 g混合物,并向其中加入过量的2.00 mol·L-1的盐酸,生成气体a mL。则a=________(填数字),据此乙同学________(填“能”或“不能”)计算出混合物两成分的质量比。若能,则m(CaCO3)∶m(KHCO3)=_________;若不能,此空不必做答。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有CaCO3和KHCO3的混合物,甲、乙两同学分别称取一定质量的该混合物来测定其中两种成分的质量比(已知K2CO3的分解温度远大于1000 ℃;气体体积均已折算成标准状况):
(1)甲同学取2.00 g混合物,并向其中加入过量的2.00 mol·L-1的盐酸,生成气体a mL。则a=____________(填数字),据此甲同学____________(填“能”或“不能”)计算出混合物两成分的质量比。若能,则m(CaCO3)∶m(KHCO3)=____________;若不能,此空不必作答。
(2)乙同学称取W g混合物充分加热,所得CO2气体的体积随温度变化的曲线如图所示,则m(CaCO3)∶m(KHCO3)=____________(请用含b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E五种物质,它们有如下反应关系:
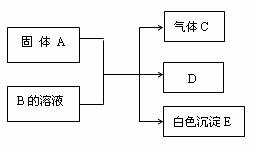
(1)若A是由短周期中原子半径最大的元素与地壳中含量最多的元素组成的离子化合物,且两种元素的原子个数比为1:1。则A中存在的化学键是 、 。
(2)若A是可溶性强碱,B是正盐,E不溶于稀硝酸,则B的化学式为 ,
(3)若A是NaHCO3,B是正盐,E既可溶于盐酸又可溶于NaOH溶液,该反应的离子方程式为 。
(4)若C是一种四原子分子,燃烧时有浓烈的黑烟。A与B的溶液反应时只生成气体C、CaCO3和H2O。
①C的电子式为 ;
B的名称为 。
②若在标准状况下,用下图的装置进行实验,欲测定某电石试样中 A 的质量分数,请回答下列问题:
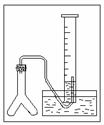
若反应刚结束时,观察到的实验现象如图所示,这时不能立即读数,应待 以后再进行的操作是: ,之后读出气体的体积是d L,如果电石试样质量为 c g,则电石试样中 A 的质量分数的计算式W ( A )= (杂质所生成的气体体积忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com