
分析 ①将粉碎,可增大接触面积,筛选后的铝土矿溶解在氢氧化钠溶液中,氧化铝和氢氧化钠反应生成偏绿酸钠溶液;
②通入过量二氧化碳使①所得溶液中,二氧化碳和偏铝酸钠反应生成氢氧化铝固体;
③高温灼烧,可使氢氧化铝脱水生成氧化铝;
④氧化铝为离子化合物,电解熔融氧化铝生成铝,以此解答该题.
解答 解:①将粉碎,可增大接触面积,筛选后的铝土矿溶解在氢氧化钠溶液中,氧化铝和氢氧化钠反应生成偏绿酸钠溶液;
②通入过量二氧化碳使①所得溶液中,二氧化碳和偏铝酸钠反应生成氢氧化铝固体;
③高温灼烧,可使氢氧化铝脱水生成氧化铝;
④电解熔融氧化铝生成铝,
(1)将矿石粉碎,可增大固体表面积,增大反应速率,故答案为:增大反应速率;
(2)偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,即AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,
故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;
(3)氢氧化铝不稳定,在加热条件下,可发生分解反应生成氧化铝,因氢氧化铝可与浓硫酸发生中和反应,则不能用浓硫酸干燥,故答案为:BD;
(4)适合用电解法冶炼的金属为活泼金属,常见有Na、Mg、Al等,故答案为:Na、Mg.
点评 本题综合考查物质的分离、提纯的应用,为高频考点,涉及铝、硅、铁的化合物的性质、常用化学用语的书写等,侧重于学生的分析、实验能力的考查,难度中等,清楚实验流程、原理是解题的关键,是对知识迁移的综合运用.


科目:高中化学 来源: 题型:选择题
| A. | 6个碳原子都在一条直线上 | B. | 有可能5个碳原子在一条直线上 | ||
| C. | 6个碳原子都在同一平面上 | D. | 6个碳原子不可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
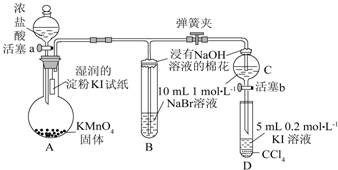
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N | B. | S | C. | Al | D. | O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
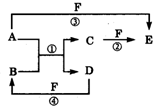 A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).
A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
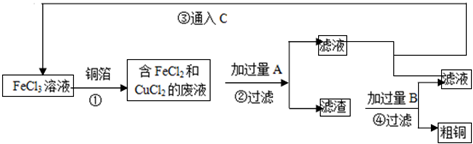
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有甲烷 | B. | 可能有乙烯 | ||
| C. | 一定不含有乙烷 | D. | 一定含有乙烯,不一定含有甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g N2含有的氮原子数目为NA | |
| B. | 常温常压下,22.4L Cl2含有的分子数目为NA | |
| C. | 1molNa变为Na+时失去的电子数目为NA | |
| D. | 1L 1mol•L-1K2CO3溶液中含有的钾离子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com