
【题目】Fe与Si形成的合金及铁的配合物用途非常广泛,回答下列问题:
(1)基态Fe2+核外价电子排布式为________;在基态Si原子中,核外存在_____对自旋方向相反的电子。
(2)Fe78Si9B13是一种非晶合金,可通过________方法区分晶体和非晶体。
(3)硅烯是一种具有石墨烯结构的新型二维材料,二硅烯Si2H4分子的几何构型为____,依据电子云的重叠方式可知其所含共价键类型是________。
(4)配合物[Fe(Htrz)3](ClO4) 2 (Htrz为![]() ,1,2,4-三氮唑)
,1,2,4-三氮唑)
①与Fe2+形成配位键的原子是_______;已知分子中的大![]() 键可用
键可用 ![]() 符号表示,其中m代表参与形成大
符号表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数,则配体
键的电子数,则配体![]() 中的大
中的大![]() 键应表示为_____
键应表示为_____
②1,2,4-三氮唑的沸点为260 ℃,环戊二烯(![]() )的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是_____ 。
)的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是_____ 。
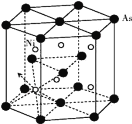
(5)砷化镍晶胞的结构如下图所示,1个砷化镍晶胞中含________个As;若六棱柱底边边长为a cm,高为c cm,阿伏加德罗数的值为NA,则砷化镍的密度为____g/cm3。
【答案】3d6 6 X射线衍射 平面形 ![]() 键和
键和![]() 键 N
键 N ![]() 1,2,4三氮唑分子间可形成氢键 6
1,2,4三氮唑分子间可形成氢键 6 
【解析】
(1) Fe2+是Fe原子失去最外层的2个电子形成的,根据构造原理可得基态Fe2+核外价电子排布式;先写出Si的核外电子排布式,根据一个原子轨道上最多容纳2个自旋方向相反的电子,结合各种轨道的数目,判断基态Si原子核外存在的自旋方向相反的电子对数;
(2)用X射线衍射实验区分晶体和非晶体;
(3)结合乙烯平面结构分析;非金属元素的原子之间通过共价键结合,根据原子之间形成的共价键数目判断共价键类型;
(4)①在配位键形成时,中心原子提供空轨道,配位体的原子提供孤电子对;根据配位体的结构确定其表示方法;
②分子之间形成氢键可增加分子之间的吸引作用;
(5)用均摊方法计算一个晶胞中含有的As、Ni原子数目,再利用密度计算公式计算晶胞密度。
(1)Fe是26号元素,基态Fe原子核外电子排布式是1s22s22p63s23p63d64s2,价层电子排布式是3d64s2,Fe原子失去最外层2个4s电子得到Fe2+,故基态Fe2+核外价电子排布式为3d6;Si是14号元素,基态Si原子中核外电子排布式是1s22s22p63s23p2,由于s轨道数目是1,p轨道数目是3,在一个原子轨道上最多容纳2个自旋方向相反的电子,且原子尽可能成单排列,而且自旋方向相同,这样原子的能量最低,处于稳定状态,则基态Si原子的核外存在的自旋方向相反的电子对数为6对;
(2)区分晶体与非晶体的方法是使用X射线衍射;
(3)C、Si是同一主族的元素,形成的化合物结构相似,由于CH2=CH2是平面结构,可推知二硅烯Si2H4分子也是平面结构,其结构简式是SiH2=SiH2;在物质分子中的共价单键都是![]() 键,共价双键中一个是
键,共价双键中一个是![]() 键,一个是
键,一个是![]() 键,故二硅烯中所含共价键类型是
键,故二硅烯中所含共价键类型是![]() 键和
键和![]() 键;
键;
(4)①在配合物[Fe(Htrz)3](ClO4)2中,Fe2+提供空轨道,配位体的N原子上含有孤电子对,因此在形成配位化合物时与Fe2+形成配位键的原子是N原子;在配位体![]() 中,参与形成大π键的原子数是5,参与形成大π键的电子数是6,所以可表示为
中,参与形成大π键的原子数是5,参与形成大π键的电子数是6,所以可表示为![]() ;
;
②1,2,4-三氮唑的沸点为260 ℃,而环戊二烯(![]() )的沸点为42.5 ℃,前者的沸点比后者大得多,是由于在1,2,4-三氮唑的分子中 N原子非金属性强,原子半径小,不同的分子之间形成了氢键,增加了分子之间的吸引作用,而在环戊二烯分子之间无氢键,因此前者熔沸点比后者高;
)的沸点为42.5 ℃,前者的沸点比后者大得多,是由于在1,2,4-三氮唑的分子中 N原子非金属性强,原子半径小,不同的分子之间形成了氢键,增加了分子之间的吸引作用,而在环戊二烯分子之间无氢键,因此前者熔沸点比后者高;
(5)根据图示可知As原子位于两个底面面心上各有1个,位于六棱柱12个顶点上个1个,在体内有3个,则该晶胞中含有的As原子数目为![]() ×12+
×12+![]() ×2+3=6;晶胞中含有的Ni原子数目为6个,则晶胞质量m=
×2+3=6;晶胞中含有的Ni原子数目为6个,则晶胞质量m=![]() g,若六棱柱底边边长为a cm,高为c cm,则晶胞体积为V=6×
g,若六棱柱底边边长为a cm,高为c cm,则晶胞体积为V=6×![]() a2c cm3,所以该晶胞的密度ρ=
a2c cm3,所以该晶胞的密度ρ= g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.三聚氰酸(C3H3N3O3)的结构式为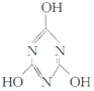 ,它属于共价化合物
,它属于共价化合物
B.只含H、N、O三种元素的化合物,可能是离子化合物,也可能是共价化合物
C.NaHCO3、HCOONa均含有离子键和共价键
D.化合物MgO、SiO2、SO3中化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图有机物的正确命名为 ( )
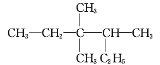
A.2-乙基-3,3-二甲基戊烷B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基己烷D.3,4,4-三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:__________。
②某元素原子的最外层电子数等于次外层电子数:__________________ 。
③L 层电子数是M层电子数2倍的元素: ___________________ 。
④某同位素原子核内没有中子的元素: ___________________ 。
(2)写出1~18号元素中符合下列条件的原子(离子)的微粒符号和结构示意图。
①某元素原子L层上的电子数为K层的3倍: __________________ 。
②某元素原子L层上的电子数为K层的一半: _________________ 。
③得到2个电子后,电子总数与氩原子的电子总数相同的离子: ___________________ 。
④某元素原子的最外层电子数等于次外层电子数的2倍: ___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(n)由于其特殊的结构,一直受到结构和理论化学家的关注,它有如下转化关系。下列说法正确的是

A. n分子中所有原子都在同一个平面上
B. n和:CBr2生成p的反应属于加成反应
C. p分子中极性键和非极性键数目之比为2:9
D. m分子同分异构体中属于芳香族化合物的共有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,体积不变的密闭容器中,发生可逆反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
A. 增大压强,平衡正向移动,此反应的ΔH仍保持不变
B. 增大O2浓度,SO2的平衡转化率减小
C. 降低温度,化学平衡常数减小
D. 升高温度,SO2的转化率一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
(1)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈__________色。
(2)实验室中需0.2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是__________。
A.1000mL;21.2g B.950mL;20.14g C.500mL;21.2g D.500mL;10.6g
(3)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为______。
(4)某同学为确定一包可能由碳酸钠和碳酸氢钠组成的白色混合物的成分,他取少量该白色物质溶于水,并向所得溶液中加入适量澄清石灰水,产生白色沉淀,据此该同学认为有碳酸钠。你是否同意该同学的观点,请你用适当的化学方程式阐述你的观点________。
(5)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:

①曲线A表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为_______mL。
②曲线B表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________,其物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com