
工业上可用铝槽储装浓硝酸,其原因是( )。
A.浓硝酸是弱酸 B.浓硝酸的氧化性比较弱
C.铝表面可被氧化生成一层致密的保护膜
D.铝的化学性质不活泼,不能够与浓硝酸发生反应
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.分子式为CH4O和C2H6O的物质一定互为同系物
B.甲烷、乙烯和苯在工业上都可通过石油分馏得到
C.苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠
D.1 mol 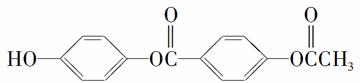 与过量的NaOH溶液加热充分反应,能消耗5 mol NaOH
与过量的NaOH溶液加热充分反应,能消耗5 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
下列递变规律正确的是( )。
A.HClO4、H2SO4、H3PO4的酸性依次增强 B.P、S、Cl最高正价依次降低
C.HCl、HBr、HI的稳定性依次增强 D.钠、镁、铝的金属性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )。
A.1molH2O中含有的原子数为NA
B.2gH2中含有的氢原子数为2NA
C.常温常压下,11.2LN2中含有的分子数为0.5NA
D.1L0.1mol·L-1 NaNO3溶液中含有的钠离子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
控制变量法是科学研究中的一种常用方法,下表中产生H2速率最快的是( )。
| 编号 | 金属(粉末状) | 物质的量 | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Al | 0.2 mol | 18.4mol/L H2SO4 | 10mL | 30℃ |
| B | Mg | 0.2 mol | 3 mol/L H2SO4 | 20mL | 30℃ |
| C | Fe | 0.1 mol | 3 mol/L H2SO4 | 20mL | 60℃ |
| D | Mg | 0.1 mol | 3 mol/L H2SO4 | 10mL | 60℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关试剂的保存方法,错误的是( )。
A.浓硝酸保存在无色玻璃试剂瓶中
B.少量的钠保存在煤油中
C.NaOH溶液保存在具有玻璃塞的玻璃试剂瓶中
D.新制氯水保存在棕色玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的原子序数为7,下列有关该元素的推断正确的是( )。
A.它处在元素周期表中第二周期ⅤA族 B.它的最高正价为+5,负价为-3
C.它的最高价氧化物对应水化物是一元强酸 D.它的非金属性比磷弱比氧强
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应2H2O2===2H2O+O2↑,下列措施不能增大其分解速率的是( )
A.向反应体系中加水
B.升高H2O2溶液的温度
C.向H2O2溶液中加入少量MnO2
D.向H2O2溶液中加入一定浓度FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如下:
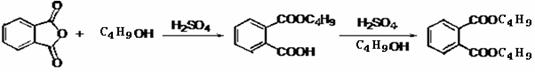
已知:正丁醇沸点118℃,纯邻苯二甲酸二丁酯是无色透明、具有芳香气味的油状液体,沸点340℃,酸性条件下,温度超过180℃时易发生分解。
由邻苯二甲酸酐、正丁醇制备邻苯二甲酸二丁酯实验操作流程如下:
①向三颈烧瓶内加入30g(0.2mol)邻苯二甲酸酐,22g(0.3mol)正丁醇以及少量浓硫酸。
②搅拌,升温至105℃,持续搅拌反应2小时,保温至反应结束。
③冷却至室温,将反应混合物倒出.通过工艺流程中的操作X,得到粗产品。
④粗产品用无水硫酸镁处理至澄清→取清液(粗酯)→圆底烧瓶→减压蒸馏,经过处理得到产品20.85g。
请回答以下问题:
(1)步骤②中不断从分水器下部分离出产物水的目的是 。
判断反应已结束的方法是_______________________。
(2)上述实验可能生成的副产物的结构简式为 (填一种即可)
(3)操作X中,应先用5% Na2CO3溶液洗涤粗产品。纯碱溶液浓度不宜过高,更不能使用氢氧化钠;若使用氢氧化钠溶液,对产物有什么影响?(用化学方程式表示) 。
(4)操作X中,分离出产物的操作中必须使用的主要玻璃仪器有 。
(5)粗产品提纯流程中采用减压蒸馏的目的是___________________________。
(6)本实验中,邻苯二甲酸二丁酯(式量是278)的产率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com