
某溶液中含有HCO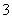 、SO
、SO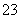 、CO
、CO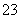 、CH3COO-4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)( )
、CH3COO-4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)( )
A.CH3COO- B.SO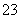
C.CO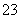 D.HCO
D.HCO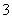
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
已知热化学方程式:2SO2(g)+O2(g)2SO3(g) ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是 ( )。
A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)
所具有的能量
B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为
Q kJ
C.增大压强或升高温度,该反应过程放出更多的热量
D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此
过程中有2 mol SO2(g)被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:
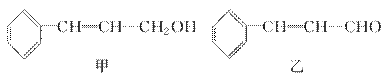
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
丙
(1)甲中含氧官能团的名称为________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
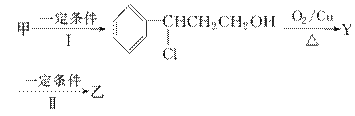
其中反应Ⅰ的反应类型为________,反应Ⅱ的化学方程式为__________________________(注明反应条件)。
(3)已知:RCH===CHR′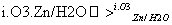 RCHO+R′CHO;
RCHO+R′CHO;
2HCHO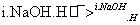 HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
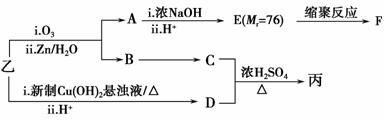
①下列物质不能与C反应的是________(选填序号)。
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
②写出F的结构简式________________________________________________________________________。
③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式________。
a.苯环上连接三种不同官能团
b.能发生银镜反应
c.能与Br2/CCl4发生加成反应
d.遇FeCl3溶液显示特征颜色
④综上分析,丙的结构简式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向分别盛有100 mL水、100 mL 0.1 mol·L-1盐酸、100 mL 0.01 mol·L-1硫酸铜溶液的X、Y、Z三个烧杯中各投入0.05 mol Na。下列有关说法正确的是( )
A.三个烧杯中均会发生的离子反应为2Na+2H2O===2Na++2OH-+H2↑
B.三个烧杯中钠均在液面上剧烈反应,且X烧杯中反应最剧烈
C三个烧杯反应后,生成的溶质的物质的量浓度相同
D.三个烧杯反应后,生成的气体的质量一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞溶液变红是因为__________,红色褪去的可能原因是__________________。
②加入MnO2反应的化学方程式为___________________________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
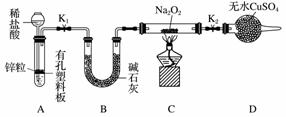
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象。
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是____________;B装置的作用是________。
②必须检验氢气纯度的原因是__________________________________________。
③设置装置D的目的是__________________________________________。
④你得到的结论是____________(若能反应请用化学方程式表示)。
答案 (1)①反应生成了碱(NaOH) 反应生成的H2O2具有漂白作用 ②2H2O2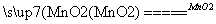 2H2O+O2↑
2H2O+O2↑
(2)①长颈漏斗 吸收氢气中的杂质气体(水蒸气、氯化氢等) ②防止空气与氢气混合加热爆炸 ③检验有无水生成 ④Na2O2+H2===2NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
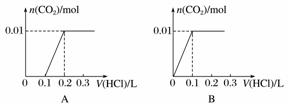
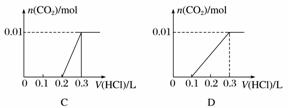
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是( )
A.切开的金属Na暴露在空气中,光亮的表面逐渐变暗,发生的反应为2Na+O2===Na2O2
B.4.6 g Na与O2完全反应,生成7 g产物时失去电子的物质的量为0.2 mol
C.Na与稀硫酸反应的离子方程式为2Na+2H+===2Na++H2↑
D.将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO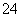 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
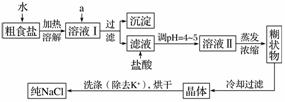
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO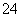 ,选出a所代表的试剂,按滴加顺序依次为____________(只填化学式)。
,选出a所代表的试剂,按滴加顺序依次为____________(只填化学式)。
(2)用于沉淀的试剂需过量,判断除去SO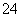 的试剂过量的方法是________________________________________________________________________。
的试剂过量的方法是________________________________________________________________________。
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com