
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧 | CO2、H2O与Na2O2反应是放热反应 |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| D | 用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色 | 原溶液中不含K+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.该白色沉淀可能为氯化银,原溶液中可能存在银离子,不一定含有硫酸根离子;
B.脱脂棉燃烧应达到燥火点;
C.该气体为二氧化碳,原溶液中可能含有碳酸氢根离子,不一定含有碳酸根离子;
D.观察钾离子的焰色反应时,必须题干蓝色的钴玻璃观察.
解答 解:A.向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解,该白色沉淀可能为氯化银,原溶液中可能含有银离子,不一定含有硫酸根离子,故A错误;
B.脱脂棉燃烧应达到燥火点,可说明CO2、H2O与Na2O2反应是放热反应,故B正确;
C.向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体,该气体为二氧化碳,但是原溶液中可能含有碳酸氢根离子,不一定含有碳酸根离子,故C错误;
D.用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色,没有透过蓝色的钴玻璃观察,不能确定是否含有钾离子,故D错误;
故选B.
点评 本题考查了常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,在检验离子存在时,需要排除干扰了,保证检验方案的严密性.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
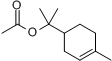 |
| 乙酸松油酯的结构式 |
| A. | 松油醇的分子式为C10H16O | |
| B. | 乙酸松油酯在NaOH溶液加热条件下得到的醋酸钠和松油醇 | |
| C. | 乙酸松油酯能发生加聚反应 | |
| D. | 乙酸松油酯能发生加成反应也能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
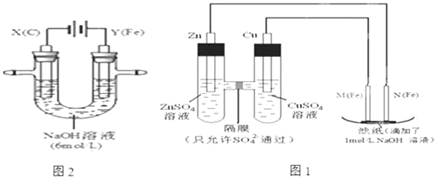
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
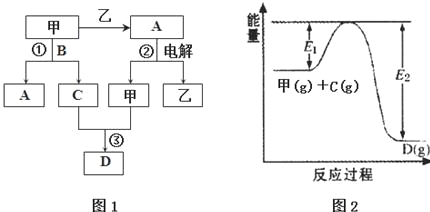
| 容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 无法判断混合物中是否含有Na2O | B. | 由Ⅱ可知X中一定存在SiO2 | ||
| C. | 1.92g固体成分为Cu | D. | 15.6g混合物X中m(Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 蒸馏时,温度计的水银球应靠近蒸馏烧瓶的底部 | |
| C. | 容量瓶用水洗净后,可不经干燥直接用于配制溶液 | |
| D. | 配制1L0.1mol/L的NaCl溶液时可用托盘天平称量5.85gNaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
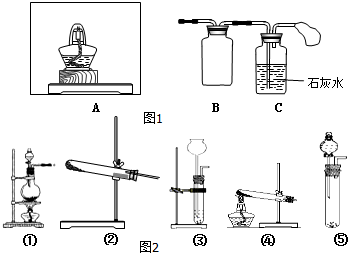 Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com