
| A. | g/L | B. | mol/L | C. | g/mol | D. | mol |
科目:高中化学 来源: 题型:解答题
 .(不考虑空间构型)
.(不考虑空间构型)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 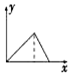 | B. | 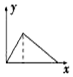 | C. | 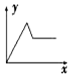 | D. | 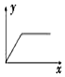 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LL任何气体都约含NA个气体分子 | |
| B. | 标准状况下,1mol液溴的体积约为22.4L | |
| C. | 1mol铁与足量盐酸反应,转移电子数为3NA | |
| D. | 18gNH4+中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
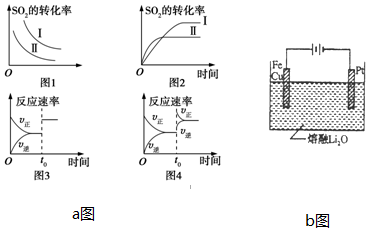
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 电离常数K |
| HX | 9×10-7 |
| HY | 9×10-6 |
| HZ | 1×10-2 |
| A. | 三种酸的强弱关系:HX>HY>HZ | |
| B. | 反应HZ+Y -=HY+Z -能够发生 | |
| C. | 相同温度下,0.1mol/L的NaX、NaY、NaZ溶液,NaZ溶液pH最大 | |
| D. | 相同温度下,1mol/L HX溶液的电离常数大于0.1mol/L HX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol HCl气体所含H+数目为NA | |
| B. | 1 mol CO2气体含有的C═O键数为NA | |
| C. | 4.6 g分子式为C2H6O的有机物,所含C-H键数目一定为0.5NA | |
| D. | 1 mol Na2O2所含的阴阳离子总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com