
【题目】用NA表示阿伏加德罗常数,下列叙述中正确的是
A. 0.1 molKI与0.1 molFeC13在溶液中反应转移的电子数为0.1NA
B. 镁条在氮气中完全燃烧,生成50g氮化镁时,有1.5NA共用电子对被破坏
C. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA
D. 标况时,22.4L二氯甲烷所含有的分子数为NA
科目:高中化学 来源: 题型:
【题目】CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,且Ca(HCO3)2易溶于水。现有Ca(OH)2溶液,向其溶液中逐渐通入CO2。则下列四个图中,能比较准确地反映出溶液的导电能力和通入CO2气体量的关系的是(x轴表示CO2通入的量,y轴表示导电能力)
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油和脂肪的说法正确的是( )
A.二者互为同分异构体B.二者仅状态不同,化学性质相同
C.前者熔点高,后者熔点低D.在一定条件下前者可转化为后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
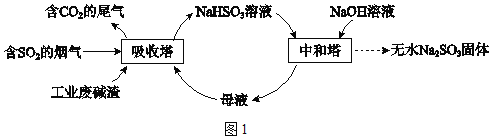
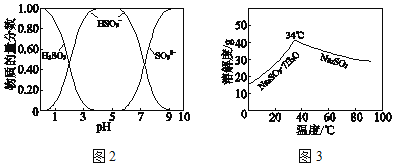
已知:H2SO3、HSO3﹣、SO32﹣在水溶液中的物质的量分数随pH的分布如图2,Na2SO37H2O 和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:_____。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为_____。
②NaHSO3溶液中c(SO32﹣)>c(H2SO3),结合方程式解释其原因:_____。
③已知下列反应:
SO2(g)+2OH﹣(aq)=SO32﹣(aq)+H2O(l) △H1=﹣164.3 kJ/mol
CO2(g)+2OH﹣(aq)=CO32﹣(aq)+H2O(l) △H2=﹣109.4 kJ/mol
2HSO3﹣(aq)=SO32﹣(aq)+SO2(g)+H2O(l) △H3=+34.0kJ/mol
吸收塔中Na2CO3溶液吸收SO2生成HSO3﹣的热化学方程式是__________。
④吸收塔中的温度不宜过高,可能的原因是_____(写出1种即可)。
(3)制备无水Na2SO3
将中和塔中得到的Na2SO3溶液_________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)2ClNO(g) K3
则K3=__________(用K1、K2表示)。
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
化学键 | N≡O (NO) | Cl-Cl | Cl-N | N=O |
键能/(kJ/mol) | 630 | 243 | a | 607 |
则反应2NO(g)+Cl2(g)2ClNO(g)的ΔH和a的关系为ΔH= _______________kJ/mol。
(3)300℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
① | 0.30 | 0.36 |
② | 0.60 | 1.44 |
③ | 0.90 | 3.24 |
n=________________;k=__________________________。
(4)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①在p压强条件下,M点时容器内NO的体积分数为______________。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图B所示,则A、B、C三状态中,NO的转化率最大的是______________点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 第三周期元素,浓度均为0.01 mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法正确的是
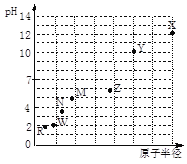
A. 气态氢化物的稳定性:N>R
B. Z的最高价氧化物对应的水化物能溶于稀氨水
C. Y和R形成的化合物既含离子键又含共价键
D. X和M两者最高价氧化物对应的水化物反应后溶液的pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如下图所示(EMI+为有机阳离子)。
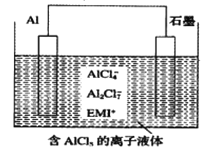
①Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) △H1=a kJ·mol-1
②3AlCl(g)===2A1(1)+AlCl3(g) △H2=b kJ·mol-1
③Al2O3(s)+3C(s)===2A1(1)+3CO(g) △H3
下列说法正确的是
A. 该电池放电时的负极反应方程式为A1-3e-+7AlCl4-===4A12C17-
B. ΔH2<0
C. 该电池充电时石墨电极与电源负极相连
D. A12O3(s)+3C(s)===2A1(1)+3CO(g) ΔH3=(a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4HS (s)![]() NH3 (g)+H2S (g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
NH3 (g)+H2S (g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
A. 温度、容积不变时,通入HCl气体 B. 分离出一部分NH3
C. 容器体积不变,充入氮气 D. 保持压强不变,充入氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所选装置或实验设计合理的是( )
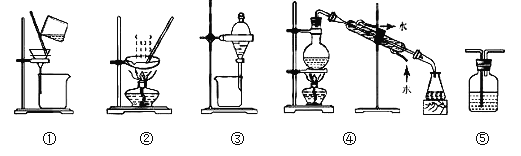
A. 用图①和②所示装置进行粗盐提纯
B. 用乙醇提取碘水中的碘选择图③所示装置
C. 用图④所示装置进行石油分馏实验制取汽油
D. 图⑤所示装置中盛有饱和Na2SO3溶液除去SO2中含有的少量HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com