
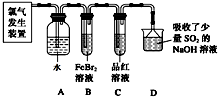


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中电子转移数为0.2NA |
| B、一定量的CO2为0.1NA |
| C、18.4 g固体物质为0.1mol Na2CO3和0.1molNa2O2的混合物 |
| D、一定量的Na2O2为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
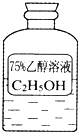 油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.
油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.| 编号 | ① | ② | ③ |
| 装置 | 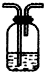 | 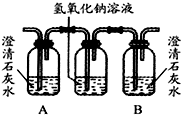 | 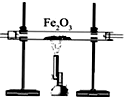 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度为298K时,pH<7 |
| B、c(CH3COOH)+c(CH3COO-)=0.1 mol?L-1 |
| C、c(CH3COOH)<c(CH3COO-) |
| D、c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
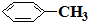 e.
e.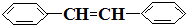 f.
f.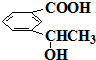
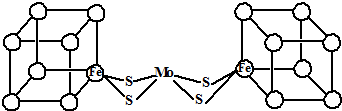
查看答案和解析>>
科目:高中化学 来源: 题型:
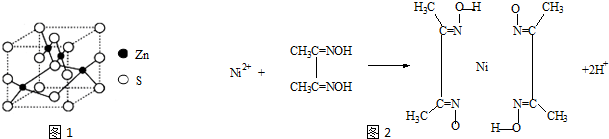
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.9 mol |
| B、1.2 mol |
| C、1.5 mol |
| D、1.8 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com