
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:填空题
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已 知:2SO2(g)+O2(g)
知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ·mol-1
2SO3(g) ΔH=-196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0kJ·mol-1
2NO2(g) ΔH=-113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=____________ kJ·mol-1。
SO3(g)+NO(g)的ΔH=____________ kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____________。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO3的同时生成1mol NO
若测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g
CH3OH(g )。CO在不同温度下的平衡转化率与压强的关系如图甲所示。该反应ΔH________0(填“>”或“<”)。
)。CO在不同温度下的平衡转化率与压强的关系如图甲所示。该反应ΔH________0(填“>”或“<”)。
图甲: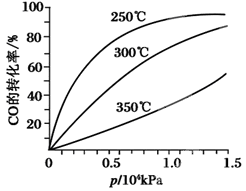 图乙:
图乙: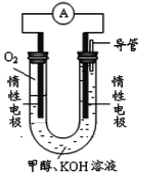
(4)依据燃烧的反应原理,合成的甲醇可以设计如图乙所示的原电池装置。
①该电池工作时,OH-向_______极移动(填“正”或“负”)。
②该电池正极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A.电解饱和食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.硫酸铵稀溶液和稀氢氧化钡溶液反应:NH4++SO42-+Ba2+ +OH-=BaSO4↓+NH3·H2O
C.把氯气通入NaOH 溶液中:Cl2+2OH-=Cl-+ClO- +2H2O
D.碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH-=H2O+CaCO3↓
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.由于铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳场馆常用硫酸铜作池水消毒剂
B.高炉炼铁得到纯度高的铁,加入其他金属炼制得到钢
C.焙制糕点的发酵粉主要成分之一是碳酸氢钠,它也是治疗胃酸过多的一种药剂
D.分子筛常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上期末化学卷(解析版) 题型:填空题
Na 、Fe 、Cl 是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是 (填化学式)。
(2)焰色反应的实验中,Na元素燃烧时的焰色为 色,观察 K元素燃烧时的焰色需要透过 。
(3)实验室在制备 Fe(OH)2 时必须隔绝空气,否则发生的现象是 。
(4)Mg与碳粉和氯气在一定条件下反应可制备 MgCl2,该反应的化学方程式为 。若尾气可用足量 NaOH溶液完全吸收,则生成的盐为 (写化学式)。
(5)由 NO、H2、CO2组成的混合气体,先通过足量的 Na2O2充分反应后,再将混合气体用电火花引燃,充分反应后最终只得到质量分数为 70%的硝酸,无其他气体剩余。则原混合气体中 NO、H2、CO2的体积比为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上期末化学卷(解析版) 题型:选择题
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装了盛有Na2O2(或 K2O2)颗粒的装置,它的用途是产生氧气。下列有关 Na2O2的叙述正确的是
A.Na2O2中阴、阳离子的个数比是 1∶1
B.Na2O2分别与水及CO2反应产生相同量氧气时,需水和 CO2的质量相等
C.Na2O2的漂白原理与 SO2的漂白原理相同
D.与 CO2、H2O反应产生等量氧气,转移电子数相同,耗Na2O2的质量相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:填空题
氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为 ______________________。
(2)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g) 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
C(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20 s内,v(NO2)=___________mol·L-1·s-1。
②升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数数值为_____________。
④相同温度下,若开始向该容器中充入0.80molNO2,则达到平衡后: c(NO2) ______ 0.30mol·L-1(填“>”、 “=”或“<”)
(3)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。
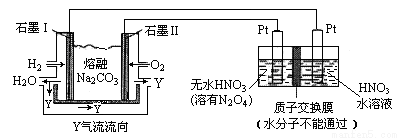
①写出石墨I电极上发生反应的电极反应式 _____________________________;
②在电解池中生成N2O5的电极反应式为 ____________________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:填空题
(1)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知:甲醇的燃烧热486为kJ·mol-1 ( 2CO (g) + O2(g) = 2CO2(g) △H b =-566.0 kJ·mol-1)
试写出CH3OH(l)在氧气中完全燃烧生成CO和H2O(l)的热化学方程式: 。
(2)常温下某溶液中由水电离的c(H+)=10-10 mol/L,则该溶液的pH为 _______。
(3)常温下,向V L pH=12的Ba(OH)2溶液中逐滴加入一定浓度的NaHSO4稀溶液,当溶液中的Ba2+恰好沉淀完全时,溶液pH=11。则Ba(OH)2溶液与NaHSO4溶液的体积比为__________,NaHSO4溶液的物质的量浓度为 。
(4)常温下,0.5mol/L的NH4Cl溶液的为pH=5.该溶液显酸性的原因是(用离子方程式表示) 。计算常温下氨水的电离平衡常数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com