
【题目】I.硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是_______________。
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)==CO2(g)+CaO(s) △H=+178.2kJ/mol
SO2(g)+CaO(s)==CaSO3(s) △H=-402kJ/mol
2CaSO3(s)+O2(g )==2CaSO4(s) △H=-234.2kJ/mol
写出石灰石脱硫的热化学反应方程式_________________________________。
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2 和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ/mol
N2(g)+CO2(g) △H=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) △H=-64.2kJ/mol
N2(g)+2CO2(g) △H=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0. 58 | 0. 40 | 0. 40 | 0. 48 | 0. 48 |
N2 | 0 | 0. 21 | 0.30 | 0. 30 | 0. 36 | 0. 36 |
①0~10min内,NO的平均反应速率v(NO)=_____,当升高反应温度,该反应的平衡常数K____________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是_________(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
(4)某实验室模拟反应b,在密闭容器中加入足量的C 和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图
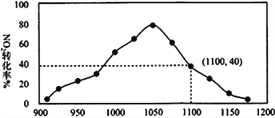
请从动力学角度分析,1050 kPa 前,反应b 中NO2转化率随着压强增大而增大的原因____________;在1100 kPa时,NO2的体积分数为_________________________。
(5)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________(计算表达式表示);已知:气体分压(p分)=气体总压(p总)× 体积分数。
【答案】B 2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) △H=-681.8kJ/mol 0.042mol/(L·min) 减小 bc 1050kPa前反应未达平衡状态,随着压强增大,反应速率加快,NO转化率提高 50% 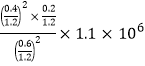 Pa或
Pa或 Pa
Pa
【解析】
(1)A.全球变暖是二氧化碳引起的温室效应,故A错误;B.酸雨主要硫氧化物和氮氧化物的排放引起的,故B正确;C.水体富营养化(水华)主要是含N和P元素的废水的排放引起的,故C错误;D.白色污染是废旧塑料引起的环境问题,故D错误;故选B;
(2)已知:①CaCO3(s)=CO2(g)+CaO(s) △H=+178.2kJ/mol,②SO2(g)+CaO(s)=CaSO3(s) △H=-402kJ/mol,③2CaSO3(s)+O2(g)=2CaSO4(s) △H=-234.2kJ/mol,石灰石、二氧化硫、氧气和水反应生成生石膏的反应为2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)=2[CaSO4.2H2O](s)+2CO2(g),根据盖斯定律,该反应等于①×2+②×2+③,计算△H=+178.2×2+(-402)×2+(-234.2)=-681.8kJ/mol,故答案为:2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)=2[CaSO4.2H2O](s)+2CO2(g)△H=-681.8kJ/mol;
(3)①0~10min内,NO的平均反应速率v(NO)=![]() = 0.042mol/(L·min);该反应为放热反应,升高反应温度,平衡逆向移动,反应的平衡常数K减小,故答案为:0.042mol/(L·min);减小;
= 0.042mol/(L·min);该反应为放热反应,升高反应温度,平衡逆向移动,反应的平衡常数K减小,故答案为:0.042mol/(L·min);减小;
②根据表格数据可知,30min后,NO的浓度增大,N2的浓度也增大。a.加入一定量的活性炭平衡不移动,错误;b.通入一定量的NO,NO的浓度增大,平衡正向移动,N2的浓度增大,正确;c.适当缩小容器的体积,所有气体的浓度均增大,正确;d.加入合适的催化剂平衡不移动,错误;故选bc;
(4)在1050kPa前反应未达平衡状态,随着压强增大,反应速率加快,NO转化率提高,在1100kPa时,NO2的转化率为40%,根据2C(s)+2NO2(g)![]() N2(g)+2CO2(g),假设二氧化氮共有2mol,则反应的二氧化氮为0.8mol,生成的氮气为0.4mol,二氧化碳为0.8mol,NO2的体积分数=
N2(g)+2CO2(g),假设二氧化氮共有2mol,则反应的二氧化氮为0.8mol,生成的氮气为0.4mol,二氧化碳为0.8mol,NO2的体积分数=![]() ×100%=50%,故答案为:1050kPa前反应未达平衡状态,随着压强增大,反应速率加快,NO转化率提高;50%;
×100%=50%,故答案为:1050kPa前反应未达平衡状态,随着压强增大,反应速率加快,NO转化率提高;50%;
(5)根据图像,T2℃、1.1×106Pa时,平衡状态下,NO2的转化率为40%,根据2C(s)+2NO2(g)![]() N2(g)+2CO2(g),假设二氧化氮共有2mol,则反应的二氧化氮为0.8mol,剩余的二氧化氮为1.2mol,生成的氮气为0.4mol,二氧化碳为0.8mol,则各物质的平衡分压分别为:二氧化氮为
N2(g)+2CO2(g),假设二氧化氮共有2mol,则反应的二氧化氮为0.8mol,剩余的二氧化氮为1.2mol,生成的氮气为0.4mol,二氧化碳为0.8mol,则各物质的平衡分压分别为:二氧化氮为![]() ×1.1×106Pa,生成的氮气为
×1.1×106Pa,生成的氮气为![]() ×1.1×106Pa ,二氧化碳为
×1.1×106Pa ,二氧化碳为![]() ×1.1×106Pa,反应的化学平衡常数Kp=
×1.1×106Pa,反应的化学平衡常数Kp=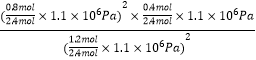 =
=![]() ×1.1×106Pa,故答案为:
×1.1×106Pa,故答案为:![]() ×1.1×106Pa。
×1.1×106Pa。


科目:高中化学 来源: 题型:
【题目】某反应的生成物Y的浓度在4min内由0变成了4mol/L,则以Y表示该反应在4min内的平均反应速率为 ( )
A. 16 mol/(L·min) B. 4 mol/(L·min)
C. 2 mol/(L·min) D. 1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在生产生活中有广泛的应用。下列叙述正确的是
A.开发新技术可将水分解成氢气、氧气并释放能量
B.研制新型催化剂可提高汽车尾气的平衡转化率
C.燃料电池能将化学能完全转化为电能
D.为防止金属管道被腐蚀,应将金属管道与电源负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中可以作为2NO2(g) ![]() 2NO(g)+O2(g)达到平衡状态的标志是( )
2NO(g)+O2(g)达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
A. ①③⑤⑦ B. ②④⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)“高分一号”卫星使用了大功率运载火箭,火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),其反应为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g),该反应生成1molH2O(g)释放出160.4kJ热量。
①H2O2的电子式为______。
②若反应后,O-H键增加了16mol,则反应释放出的热量为______kJ。
(2)镍氢蓄电池具有能量密度大、电压高、可多次反复充放电等特性,该电池放电时,正极反应式为2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-,负极反应式为H2+2OH-+2e-=2H2O。
①该镍氢蓄电池放电时的电池总反应为____。
②该电池放电时,OH-向____(填“正极”或“负极”)移动。
③假设该电池放电时有2.408×1024个电子从负极流向正极,则消耗的H2在标准状况下的体积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
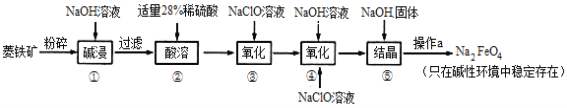
(1)Na2FeO4中铁元素的化合价为______,高铁酸钠用于杀菌消毒时的化学反应类型为_________(填“氧化还原”、“复分解”或“化合”)反应。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是______________________________________________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还需要______(填字母序号)。
A.容量瓶 B.烧杯 C.圆底烧瓶 D.玻璃棒
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________________已知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_________。
(5)理论上,每获得0.5 mol的FeO42-消耗NaClO的总质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是
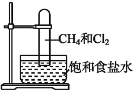
A. 此反应无光照也可发生
B. 甲烷和Cl2反应后的产物只有CH3Cl和HCl
C. 盛放饱和食盐水的水槽底部会有少量晶体析出
D. CH4和Cl2完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于将煤转化为水煤气作能源的优点是( )
A.有利于提高燃料的燃烧效率B.有利于减少排放大气污染物
C.有利于管道输送D.有利于放出更多热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油炼制过程中产生的大量H2S废气的处理设计方案如下图所示,下列说法不合理的是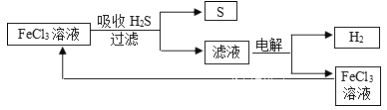
A. 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+
B. 电解过程中的阳极可发生的竞争反应主要为:2Cl--2e-=Cl2↑
C. 该工艺流程设计上处理废气H2S的同时也获得产品H2和S
D. 实验室可用点燃充分燃烧的方法消除H2S污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com