
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、砷化镓(GaAs)太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)镓元素位于元素周期表的____周期_____族,砷原子核外的电子有___种运动状态。
(2)Si、P、S 的第一电离能由大到小的顺序是 _____________, 二氧化硅和干冰晶体的熔点差别很大,其原因是________________________________________________。
(3)与AsF3互为等电子体的分子为___________(只写一中),其空间构型为_________。
(4)硼酸(H3BO3)本身不能电离出H+,在水溶液中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为______________。
②[B(OH)4]-的结构式为________________。
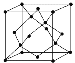
(5)金刚石的晶胞如图所示,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是________________(用化学式表示);
②金刚石的晶胞参数为a pm(1 pm=10-12 m)。 金刚石晶胞的密度为_________g/cm3(只要求列算式,阿伏加德罗常数为NA)。
【答案】4 ⅢA 33 P>S>Si SiO2是原子晶体,融化时需破坏共价键,干冰是分子晶体,融化时需破坏范德华力,共价键的键能远大于范德华力,所以二氧化硅的熔点远高于干冰晶体 PCl3 三角锥形 sp3 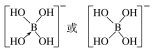 C>SiC>Si 9.6×1031/a3NA
C>SiC>Si 9.6×1031/a3NA
【解析】
(1)镓元素为31号元素,位于元素周期表的4周期ⅢA 族,砷原子核电荷数为33,核外的电子有33运动状态;综上所述,本题答案是:4,ⅢA,33。
(2) 同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素;Si、P、S元素处于同一周期且原子序数逐渐增大,P处于第VA族,所以第一电离能:P>S>Si;SiO2是原子晶体,融化时需破坏共价键,干冰是分子晶体,融化时需破坏范德华力,共价键的键能远大于范德华力,所以二氧化硅的熔点远高于干冰晶体;综上所述,本题答案是:P>S>Si,SiO2是原子晶体,融化时需破坏共价键,干冰是分子晶体,融化时需破坏范德华力,共价键的键能远大于范德华力,所以二氧化硅的熔点远高于干冰晶体。
(3) 原子数和价电子数都相等的微粒互为等电子体,所以与AsF3互为等电子体的分子为PCl3, PCl3分子是以磷原子为中心,含有σ键有3个,有一对孤对电子,因此杂化方式为sp3 ,则其空间构型为:三角锥型;综上所述,本题答案是:PCl3 , 三角锥形。
(4)①[B(OH)4]-中B原子的价层电子对数是4,杂化类型为sp3;综上所述,本题答案是:sp3 。
②硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性,这说明[B(OH)4]-中含有配位键,则结构式为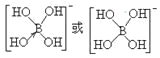 ;综上所述,本题答案是:
;综上所述,本题答案是: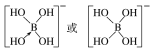 。
。
(5)①金刚石、晶体硅、碳化硅都是原子晶体,半径越小,熔点越高,即熔点高低顺序为C>SiC>Si;综上所述,本题答案是:C>SiC>Si。
②根据金刚石的结构可以判断出金刚石的一个晶胞中含有的碳原子数=8×1/8+6×1/2+4=8,其质量为8×12g;金刚石的晶胞参数为a ×10-10cm,一个晶胞的体积为a3 ×10-30 cm3,所以金刚石晶胞的密度为8×12/(NA×a3 ×10-30)= 9.6×1031/a3NA g/cm3;综上所述,本题答案是:9.6×1031/a3NA。


科目:高中化学 来源: 题型:
【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)
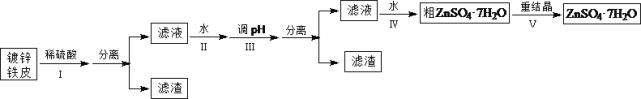
相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
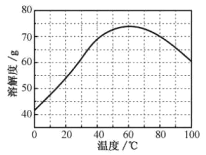
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。
请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是_______________________________。②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是_______________________________。
(2)步骤Ⅱ,需加入过量H2O2,理由是_______________________________。
(3)步骤Ⅲ,合适的pH范围是_______________________________。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。请给出上述操作的正确顺序___________________(操作可重复使用)。
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图1所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择_________方式进行冷却结晶。
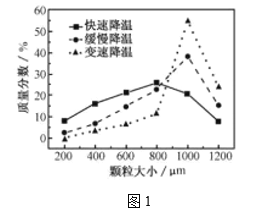
A.快速降温 B. 缓慢降温 C.变速降温
(6)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
① 下列关于滴定分析,正确的是________________。
A.图2中,应将凡士林涂在旋塞的a端和旋塞套内的c端

B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
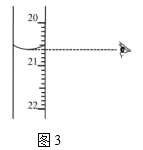
②图3中显示滴定终点时的度数是_____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如下图所示:
bM(g),M、N的物质的量随时间的变化曲线如下图所示:

(1)此反应的化学方程式中,已知计量系数比为最简整数比,则b=______。
(2)若t2-t1=10 min,则从t1到t2时刻,以M的浓度变化表示该反应的平均反应速率,计算出来的结果为_______mol/(L·min)。
(3)t1、t2、t3三个时刻中,______时刻达到反应的最大限度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的新制氯水分别滴加到下列溶液或滤纸上,对所观察到的现象描述合理的一组是
AgNO3溶液 | 蓝色石蕊试纸 | Na2CO3溶液 | |
A | 产生沉淀 | 变红后无现象 | 有气泡 |
B | 无明显现象 | 变红后无现象 | 产生沉淀 |
C | 产生沉淀 | 先变红后褪色 | 有气泡 |
D | 产生沉淀 | 先变红后褪色 | 产生沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用化学用语回答下列问题:
(1)写出二氧化碳分子的电子式:_______;
(2)写出氮气分子的结构式______。
Ⅱ.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩C2H6,含有极性键和非极性键的是_____;(填序号)
Ⅲ.下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④硫酸溶于水;⑤蔗糖溶于水;⑥HI分解;⑦ 碘升华;⑧溴蒸气被木炭吸附。
(1)未破坏化学键的是____;(填序号)
(2)仅离子键被破坏的是___。(填序号)
Ⅳ.下列物质:①1H、2H、3H;②H2O、D2O、T2O;③O2、O3;④14N、14C
(1)互为同位素的是:_____;(填序号)
(2)互为同素异形体的是:____;(填序号)
(3)氢的三种原子1H、2H、3H与氯的两种原子35Cl、37Cl相互结合为氯化氢,可得分子中相对分子质量不同的有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的判断正确的是( )
A.有机化合物都是从有机体中提取分离出来的
B.有机化合物都能燃烧
C.有机化合物不一定都不溶于水
D.有机化合物不具备无机化合物的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Ga元素因其在生产、生活和科研领域的重要作用而备受关注。
请回答下列问题:
(1)基态Ga原子中含有___________________种能量不同的电子,其中能量最高的电子的电子云轮廓图的形状为_________________________。
(2)Ga单质有晶体和玻璃体两种形态,区别二者最可靠的科学方法为_____________________。
(3)Ga分别与N、P、AS形成化合物的晶体结构与金刚石相似,其熔点如下表所示:
物质 | GaN | GaP | GaAs |
熔点/℃ | 1700 | 1465 | 1238 |
①从结构的角度分析,三种晶体熔点不同的原因为____________________________________。
②GaN晶体中含有的化学键类型为______________(填选项字母)。
A.离子键 B.配位键 C.σ键 D.π键 E.氢键
③GaP的晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。若GaP晶体的密度为pg·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为____________nm。
(4)第二周期元素中,基态原子的第一电离能大于基态氮原子的有__________种。
(5)NaNH2是一种重要的工业原料。
①钠元素的焰色反应为黄色。很多金属元素能产生焰色反应的微观原因为___________________。
②NH2-中氮原子的杂化方式为_____________;该离子的空间构型为________________。
③写出与NH2-互为等电子体的分子的化学式:____________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M为原子序数依次增大的短周期元素,周期表中X原子半径最小,Y元素形成化合物种类最多,Z元素的氢化物水溶液呈碱性,常温下L可以形成两种液态氢化物,M的最高价氧化物对应的水化物呈两性。回答下列问题:
(1)L元素形成单质的名称为______;M在元素周期表中的位置为____;五种元素的原子半径从大到小的顺序是______(用元素符号表示)。
(2)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为______。
(3)写出由X、Z、L三种元素组成的离子化合物与稀的NaOH溶液加热反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )

A. a点时溶液中存在c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. 0~a段溶液中水电离出的OH-浓度先增大后减小
C. a=0.2
D. ab段发生反应的离子方程式为CO32-+2H+=H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com