
【题目】在25mL 0.1mol/L NaOH 溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是

A. A、B 之间任意一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. B点,a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
C. C点:c(Na+)>c(CH3COO-)> c(H+) > c(OH-)
D. D点:c(CH3COO-)+c(CH3COOH)=2c(Na+ )
【答案】D
【解析】
用CH3COOH滴定NaOH,CH3COOH为弱酸,当滴定到终点时产物是CH3COONa,溶液显碱性,然后利用弱电解质的电离、盐类水解、“三个守恒”进行分析;
A、本实验是用CH3COOH滴定NaOH,A、B间溶液中溶质为NaOH和CH3COONa,当n(NaOH)>n(CH3COONa),会出现c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故A错误;
B、当NaOH和CH3COOH恰好完全反应时,溶质为CH3COONa,溶液显碱性,B点对应的pH=7,即此时溶液中的溶质为CH3COONa和CH3COOH,a>12.5,有c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故B错误;
C、C点溶液显酸性,即c(H+)>c(OH-),根据电荷守恒,有c(CH3COO-)>c(Na+)故C错误;
D、D点时加入25mL醋酸,反应后溶质为CH3COONa和CH3COOH,且两者物质的量相等,依据物料守恒,推出c(CH3COO-)+c(CH3COOH)=2c(Na+),故D正确;
答案选D。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是

A. 离O点越远的元素原子半径越大 B. 虚线相连的元素处于同一族
C. B元素是图中金属性最强的元素 D. A、B组成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中成药连花清瘟胶囊在对抗 H1N1 病毒中发挥重大作用,其有效成分绿原酸的结构简式如图,下列有关说法错误的是( )

A.绿原酸属于芳香族化合物
B.分子式 C16H18O9
C.1mol 绿原酸与 Na 反应放出 H2 的体积 134.4L
D.1mol 绿原酸可以与 7molH2 发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A 是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2 ![]() 2CH3COOH。F 是高分子化合物。现以 A 为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。F 是高分子化合物。现以 A 为主要原料合成乙酸乙酯,其合成路线如下图所示。

回答下列问题:
(1)A 的电子式为______,结构简式为_______。
(2)B、D 分子中的官能团名称分别是_______、_______。
(3)反应①~⑤的反应属于取代反应的是:_____。
(4)写出下列反应的化学方程式:①_____、④______、⑤_______。
(5)下列物质中,可以通过 A 加成反应得到的是_____(填序号)。
A.CH3CH3
B.CH3CHCl2
C.CH3CH2OH
D.CH3CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是

A. II表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C. V(NaOH)=" 20.00" mL时,两份溶液中c(Cl-)= C(CH3COO-)
D. V(NaOH) ="10.00" mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.5 mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出320.8 kJ的热量。
(1)肼的电子式为___________________,过氧化氢的电子式为__________________。
(2)写出反应的热化学方程式:________________________________________________。
(3)在25 ℃、101 kPa时,已知18 g水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表:
O===O | H—H | H—O(g) | |
1 mol化学键断裂时 需要吸收的能量/kJ | 496 | 436 | 463 |
写出表示H2燃烧热的热化学方程式___________________________________________;则32 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________kJ。
(4)联氨和H2O2可作为火箭推进剂的主要原因为_________________________________。
(5)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为____________(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_______________。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钙可用生产疏酸、漂白粉等一系列物质。下列说法正确的是
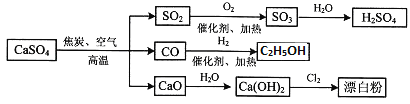
A.由CO与H2合成CH3CH2OH的反应中,原子利用率为100%
B.向蔗糖中加入浓硫酸,蔗糖变黑并产生刺激性气味的气体,说明浓硫酸具有脱水性和强氧化性
C.二氧化硫和漂白粉都能使品红溶液褪色,两者漂白性质相同
D.图中所有反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。

(1)“O”点为什么不导电___________________。
(2)a、b、c三点的氢离子浓度由小到大的顺序为____________。
(3)a、b、c三点中,醋酸的电离程度最大的一点是_________。
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水
E.加固体CH3COONa F.加Zn粒 G.加MgO固体 H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是______________。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com