
某混合溶液中可能含有下列离子中的若干种:NH4+、Na+、Al3+、Fe2+、Fe3+、AlO2-、SO42-、I-、NO3-、CO32-,已知各离子的浓度均约为0.1mol/L,现取两份20mL该溶液进行如下实验:(1)第一份加入足量盐酸,产生气体在空气中变为红色,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生。(2)第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,并有气体逸出。根据上述实验情况,以下说法错误的是
A.该混合溶液中一定不含有Fe3+、AlO2-、Al3+、CO32-
B.该混合溶液通过继续进行焰色反应可以间接确定是否含有I-
C.该混合溶液中肯定含有Fe2+、NH4+、SO42-、NO3-
D.向该混合溶液中滴加酚酞试液后呈红色
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年四川省成都市第三次诊断化学试卷(解析版) 题型:简答题
(16分)工业上硫酸锰铵[(NH4)2Mn(SO4)2]可用于木材防火涂料等。其制备工艺如下: 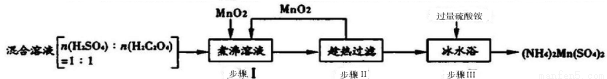
已知步骤Ⅰ反应:H2C2O4(aq) +H2SO4(aq) +MnO2(s) MnSO4(aq)+2CO2(g)+2H2O(1) △H
MnSO4(aq)+2CO2(g)+2H2O(1) △H
(1)在步骤I的反应中,氧化剂是 。
(2)步骤Ⅱ中趁热过滤前需向MnSO4溶液中加入少量热水,其目的是____;步骤III所得(NH4)2Mn(SO4)2:晶体需用酒精溶液洗涤,洗去的主要杂质离子有____ 。
(3)下列操作有利于提高产品产率的是____(填序号)。
A.慢慢分次加入二氧化锰 B.趁热过滤
C.冰水浴充分冷却 D.用水代替酒精溶液洗涤
(4)一定条件下,在步骤I的水溶液中l mol MnO2完全反应相相对能量变化如图。则△H=____;催化剂是否参加化学反应? (填“是”或“否”或“不确定”)。

(5)碱性干电池中含大量MnO2可以回收利用,该电池工作时的正极反应式为____ ;若从干电池中回收87 kg MnO2,理论上可以获得(NH4)2Mn( S04)2 _kg。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三四月考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列有关说法正确的是
A.反应KIO3+6HI=KI+3H2O+3I2 ,生成3mol I2转移电子的总数为6NA
B.标准状况下,由0.4 mol H2O2生成O2转移的电子数目为0.2NA
C.12g石墨和C60的混合物中质子总数为6NA
D.室温下,1L pH=13的NaOH溶液中,由水电离的OH- 离子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第七次模拟考试理综化学试卷(解析版) 题型:简答题
(17分)
(1)在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)
 2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是 (填序号字母)
2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是 (填序号字母)
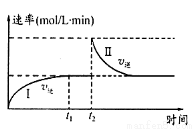
a.0~t1时,v正>v逆 ,t2时,v逆>v正
b.混合气体的密度不再改变时,Ⅰ、Ⅱ两过程达到平衡
c.t2时刻改变的条件可以是向密闭容器中加C
d.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。
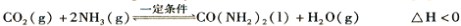
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO2和0. 40 molNH3,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
时间/min | 0 | 20 | 70 | 80 | 100 |
n(CO2) /mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
①20 min时,平均反应速率υ (CO2 )= mol/L·min。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将 (填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_ (保留一位小数)。
④下图所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为 ,
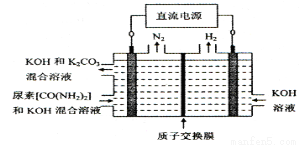
(3)CH4燃料电池,装置示意如图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。当 V=44.8 L时,电池总反应方程式为 ;用该电池为电源,以石墨作电极,电解上述实验分离出的溶液,两极均产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是________________。
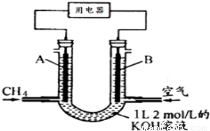
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第七次模拟考试理综化学试卷(解析版) 题型:选择题
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项 | 现象或事实 | 解释 |
A | 用活性炭去除冰箱中的异味 | 发生了化学变化 |
B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
D | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 没有发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:选择题
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三4月过程性检测理综化学试卷(解析版) 题型:选择题
饱和氯水中存在平衡:①C12+H2O H++Cl—+HClO,②HClO
H++Cl—+HClO,②HClO H++ClO—,取饱和氯水分别进行下列实验,相应结论错误的是
H++ClO—,取饱和氯水分别进行下列实验,相应结论错误的是
A.逐滴加入氨水中,所得溶液中c(H+)逐渐增大
B.继续通入过量C12,①、②均向右移动,溶液pH减小
C.加入CaCO3悬浊液中,CaCO3的溶解平衡向右移动
D.加入一定量NaOH溶液中,所得溶液中离子浓度的关系可能为c(Cl-)+ c(ClO-)= c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川一中高三第二次模拟考试 理综化学试卷(解析版) 题型:选择题
反兴奋剂是体育赛事关注的热点,利尿酸是一种常见的兴奋剂,其分子结构如下:关于利尿酸的说法中,正确的是
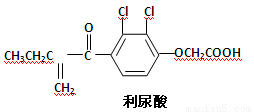
A.它的分子式是C13H11O4Cl2
B.它不能使酸性高锰酸钾溶液褪色
C.它不能与饱和碳酸钠溶液反应放出CO2
D.它能发生取代反应、加成反应和酯化反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:选择题
(B)佳味备醇存在于槟榔子叶中,其结构如下,下列有关佳味备醇的说法中不正确的是
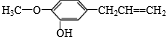
A.佳味备醇含有一个苯环,它是一种芳香族化合物
B.佳味备醇可以与溴水发生加成和取代反应,还能与氯化铁溶液发生显色反应
C.佳味备醇分子中至少有十二个原子在同一平面上
D.1 mol佳味备醇分别与氢气、溴水反应时,最多消耗4 mol H2,4 mol Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com