
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl HBr HI |
| 能量 | 243 | 193 | 151 | 436 | 568 | 432 366 298 |
分析 (1)破坏1mol 物质中的化学键所消耗的能量越高则说明物质越稳定,物质具有的能量越低;
(2)根据破坏1 mol物质中的化学键所消耗的能量越大,则物质越稳定;
(3)形成新键释放的热量和旧键断裂吸收的热量多少判断;
(4)相同条件下,等物质的量的X2(卤素单质)分别与足量的氢气反应,依据键能计算分析判断;
(5)依据同主族元素非金属性越强,氢化物越稳定,能量越低,放出的热量越多解答.
解答 解:(1)根据表中数据可知,破坏1molCl2中的化学键所消耗的能量为234KJ,破坏1molBr2中的化学键所消耗的能量为193KJ,破坏1molI2中的化学键所消耗的能量为151KJ,破坏1molH2中的化学键所消耗的能量为436KJ,所以破坏1mol 氢气消耗能量最高,氢气最稳定,能量最低;
故选:A;
(2)根据表中数据可知,破坏1mol氯化氢中的化学键所消耗的能量最高,则说明HF最稳定;
故选:A;
(3)根据反应X2+H2═2HX,新键生成释放的热量按照HCl、HBr、HI顺序分别是:432×2=864kJ、366×2=732kJ、298kJ×2=596kJ,旧键断裂吸收的热量的热量按照HCl、HBr、HI顺序分别是243+436=679kJ、193+436=629kJ、151+436=587kJ,所以新键生成释放的能量均大于旧键断裂吸收的热量,所以X2+H2═2HX的反应是放热反应,
故答案为:放热;
(4)根据表中数据可知,破坏1mol物质中的化学键所消耗的能量越高,生成物越稳定,发生该反应放出的热量越多,故答案为:Cl2;
(5)若无上表中的数据,能正确回答出问题(4),因为,Cl、Br、I为同主族元素,依据同主族元素性质递变规律可知,Cl、Br、I非金属性依次减弱,非金属性越强,与氢气化合越容易,反应放出热量越多,生成的氢化物越稳定;
故答案为:能;元素的非金属性越强,生成物越稳定,放出的热量越多,在这几种HX中,HCl最稳定,放出的热量多.
点评 本题考查了化学键与反应物稳定性的关系,明确键能大小与物质的稳定性关系是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 用图1装置构成锌--铜原电池 | |
| B. | 用图2装置选择裂化汽油提取溴水中溴 | |
| C. | 用图3装置灼烧碳酸钙制取少量氧化钙 | |
| D. | 用图4装置验证在该条件下铁钉发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有碳、氢两种元素组成的有机化合物称为烃 | |
| B. | 乙醛和乙酸都含有碳氧双键,二者都能发生加成反应 | |
| C. | 苯可以发生加成反应,但苯中不含有碳碳双键 | |
| D. | 乙醇和苯酚都含有羟基都能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
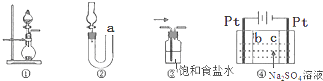
| A. | 图①可用于实验室制取少量NH3或O2 | |
| B. | 可用从a处加水的方法检验图②装置的气密性 | |
| C. | 实验室可用图③的方法除去Cl2中混有的HCl | |
| D. | 利用图④装置制硫酸和氢氧化钠,其中b为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可根据同周期元素的第一电离能变化规律,推出Al的第一电离能比Mg大 | |
| B. | 结构和组成相似的分子晶体,沸点随相对分子质量增大而升高,推出NH3的沸点低于PH3 | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据溶解度小的沉淀易向溶解度更小的沉淀转化的规律,推出在ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有12mol σ键 | |
| B. | Z的最高价含氧酸分子中,羟基氧和非羟基氧个数比为1:1 | |
| C. | Y的气态氢化物分子中H-Y-H键角比Y的最高价氧化物分子中O-Y-O键角小 | |
| D. | Z的气态氢化物比Y的气态氢化物稳定,是因为氢键的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的一定是增大压强 | |
| B. | 图2表示催化剂能改变化学反应的焓变 | |
| C. | 图3表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 图3表示向稀CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com