
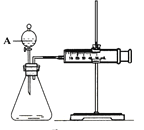
【题目】用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7克镁带,按右图连接好装置,从A中加入20.0mL 0.5mol/LH2SO4。记录注射器活塞的位置和相应的时间。记录数据如下:
时间/s | 0 | t | 2t | ...... |
活塞的位置/mL | 17.3 | 25.6 | 36.6 | ...... |
(1)检查该装置气密性的方法是 ___________________。
(2)仪器A的名称是__________________________。
(3)0-t时间段与t-2t时间段,化学反应速率最快的是_______,原因是______________。
(4)用上述装置探究Fe3+、Cu2+对双氧水分解速率的影响,所用试剂:5%H2O2、0.1mol/LFeCl3、0.2mol/LCuCl2,完成下表的实验设计:
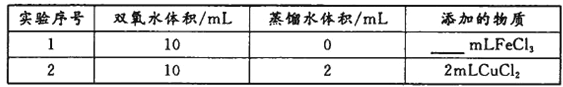
①上表中需要添加的物质是_________mL FeCl3溶液。
②本实验需要测定的数据是____________________________。
(5)为确定MnO2催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如下表。
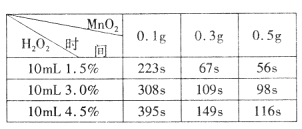
分析表中数据回答下列问题:
①相同浓度的过氧化氢的分解速率随着MnO2用量的增加而_______(填“加快”、“减慢”或“不变”)。
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入__________ g的MnO2为较佳选择。
③该小组的某同学分析上述数据后认为:“当用相同质量的MnO2时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?______(填“正确”或“不正确”),理由是_____________。(提示:H2O2溶液的密度可认为近似相等。)
(6)50mL0.50 mol·L-1的盐酸与50mL0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。
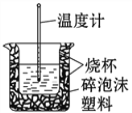
请回答下列问题:从实验装置上看,图中尚缺少的一种玻璃仪器是____________________,烧杯间填满碎泡沫塑料的作用是____________________________________。大烧杯上如不盖硬纸板,则求得的中和热数值____________(填“偏大” “偏小”或“无影响”)。
(7)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________(结果保留一位小数)。
【答案】将装置安装好后,关闭分液漏斗活塞,将注射器活塞拉出一定距离,然后松开活塞,若活塞回到原位则气密性良好;或先将活塞位置固定好,然后从分液漏斗中加水,若水不能顺利流下,则装置气密性好(其他合理方案也可)分液漏斗t-2t镁与硫酸反应放热,温度升高,反应速率加快4收集相同体积的氧气所需时间(或相同时间产生氧气的体积)加快0.3不正确H2O2的浓度扩大2倍(从1.5%-3.0%),但反应所需时间比其2倍小得多环形玻璃搅拌减少热量损失偏小-53.8kJ/ mol
【解析】
(1)通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象判断装置气密性,所以检验该套装置的气密性的方法为:将装置安装好后,关闭分液漏斗活塞,将注射器活塞拉出一定距离,然后松开活塞,若活塞回到原位则气密性良好;或先将活塞位置固定好,然后从分液漏斗中加水,若水不能顺利流下,则装置气密性好,故答案为:将装置安装好后,关闭分液漏斗活塞,将注射器活塞拉出一定距离,然后松开活塞,若活塞回到原位则气密性良好;或先将活塞位置固定好,然后从分液漏斗中加水,若水不能顺利流下,则装置气密性好;
(2)根据实验室常见仪器名称判断,盛装双氧水的化学仪器A具有活塞装置的漏斗,名称是分液漏斗,故答案为:分液漏斗;
(3)0-ts,生成气体25.6-17.3=8.3mL,t-2t,生成气体36.6-25.6=11mL,相同时间生成气体的体积t-2t 多,所以t-2t 快,是因为镁与硫酸反应放热,温度升高,反应速率加快,故答案为:t-2t;镁与硫酸反应放热,温度升高,反应速率加快;
(4)①该实验的目的为探究催化剂对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,实验1和2需体积相同,所以需4mLFeCl3,故答案为:4;
②探究Fe3+、Cu2+对双氧水分解速率的影响,可以通过过氧化氢分解生成的氧气的量判断,可收集相同体积的氧气所需时间(或相同时间产生氧气的体积)测定,故答案为:收集相同体积的氧气所需时间(或相同时间产生氧气的体积);
(5)①由表中数据可知,双氧水的量相同,加入的二氧化锰质量越多,反应所需的时间越短,说明反应速率越快,故答案为:加快;
②根据表中数据,在双氧水的浓度相同时,加入0.3g二氧化锰与加入0.1g二氧化锰对化学反应速率影响相差较大,加入0.3g二氧化锰与加入0.5g二氧化锰对反应速率的影响相差不是很大,所以加入二氧化锰的最佳量为0.3g,故答案为:0.3;
③从表中数据可知,相同体积3.0%的双氧水中的溶质含量是1.5%的双氧水中溶质含量的二倍,但反应的时间却比其反应时间的二倍小得多,由反应速率计算公式(v=![]() )可得出,此实验条件下双氧水的浓度越大分解速率越快,故答案为:不正确;H2O2的浓度扩大二倍(从1.5%-→3.0%),但反应所需时间比其二倍小的多;
)可得出,此实验条件下双氧水的浓度越大分解速率越快,故答案为:不正确;H2O2的浓度扩大二倍(从1.5%-→3.0%),但反应所需时间比其二倍小的多;
(6)该实验中还缺少环形玻璃搅拌棒,搅拌混合溶液使溶液混合均匀;泡沫有保温性能,所以其作用是保温隔热,防止热量散失;大烧杯上如不盖硬纸板,会导致部分热量散失,导致测定结果偏小,故答案为:环形玻璃搅拌棒;保温隔热,减少热量散失;偏小;
(7)第1次实验盐酸和NaOH溶液起始平均温度为20.1℃,反应后温度为:23.2℃,反应前后温度差为:3.1℃;第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.4℃,反应前后温度差为:3.1℃;第3次实验盐酸和NaOH溶液起始平均温度为20.4℃,反应后温度为:25.6℃,反应前后温度差为:5.2℃,与前2次相差较大,不符合要求,删除;50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×![]() =1.2958kJ,即生成0.025mol的水放出热量为:1.2958kJ,所以生成1mol的水放出热量为1.2958kJ×
=1.2958kJ,即生成0.025mol的水放出热量为:1.2958kJ,所以生成1mol的水放出热量为1.2958kJ×![]() =51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJmol-1。
=51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJmol-1。


科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体。旧|法合成的反应是:
①(CH3)2C=O+HCN→(CH3)2C(OH)CN
②(CH3)2C(OH)CN+CH3OH+H2SO4→CH2=C(CH3)COOCH3+NH4HSO4
新法合成的反应是:③CH3C≡CH+CO+CH3OH![]() CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
下列说法不正确的是
A. 反应②中CH3OH是CH2OHCH2OH(乙二醇)的同系物
B. 反应③符合绿色化学思想
C. 甲基丙烯酸甲酯有两种官能团
D. 反应①是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空
Ⅰ.已知: ① 2C3H8(g) + 7O2(g) ===6CO(g) + 8H2O(l) ΔH=-2741.8 kJ/mol
② 2CO(g) + O2(g) ===2CO2(g) ΔH=-566 kJ/mol
(1)反应C3H8(g) + 5O2(g) ===3CO2(g) + 4H2O(l)的ΔH=___________________________________
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH>0
CO2(g) + H2(g) ΔH>0
① 下列事实能说明该反应达到平衡的是___________(填序号)
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
② 在某温度下,反应物的起始浓度分别为:c(CO)=1 mol/L, c(H2O)=2.4 mol/L; 达到平衡后,CO的转化率为60%,该反应在此温度下的平衡常数是___________
(3)熔融碳酸盐燃料电池的电解质为Li2CO3和 Na2CO3的混合物,燃料为CO,在工作过程中,电解质熔融液的组成、浓度都不变,写出负极发生的电极反应式_________________。
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:
____SiO2 + C + N2![]() Si3N4 + CO 根据题意完成下列各题:
Si3N4 + CO 根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30 mol氮气,反应生成了5 mol一氧化碳,则此时混合气体的平均摩尔质量是______________。
(3)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是__________(填序号)
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图回答下列问题。

(1)该原电池外电路中电流方向:锌_________铜(填“→”或“←”)。
(2)该原电池中_________电极(写出电极材料名称)产生无色气泡,写出该电极反应式:________;该电极发生 ______________反应(填“氧化”或“还原”)。当电路中通过0.2mol电子时,该电极上产生的气体在标准状况下的体积为_________L。
(3)一段时间后,烧杯中溶液的pH_____________(填“增大”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的说法中,正确的是
A.合金的熔点一定比各成分金属的低
B.钢是目前用量最大、用途最广的合金
C.在我国使用最早的合金是生铁
D.储氢合金能大量吸收H2,但不与H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是( )
A. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
B. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡: NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,一定不能自发进行的是( )
A. 2KClO3(s)===2KCl(s)+3O2(g) ΔH=-78.03kJ/mol ΔS=1110 J/(mol·K)
B. CO(g)===C(s,石墨)+![]() O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3kJ/mol ΔS=-280.1 J/(mol·K)
D. NH4HCO3(s)+CH3COOH(aq)===CO2(g)+CH3COONH4(aq)+H2O(l) ΔH=37.301kJ/mol ΔS=184.05 J/(mol·K)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,依次属于单质、酸、盐的一组是
A. 液氯、硝酸、纯碱 B. 干冰、石灰石、氧化钙
C. 钠、烧碱、食盐 D. 氧气、盐酸、熟石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用水可以鉴别苯、四氯化碳、乙醇三种无色液体
B. 用Cu(OH)2悬浊液可以鉴别乙醇、乙酸溶液、葡萄糖溶液
C. 石油的分馏、煤的液化和气化都是物理变化,石油的裂化、裂解都是化学变化
D. 制取环氧乙烷:2CH2=CH2+O2Ag,250℃2![]() ,符合绿色化学的理念
,符合绿色化学的理念
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com