
【题目】已知X、M都是中学教材中的常见元素,(甲) X O3n-+Xn-+ H+ →X(单质)+ H2O(未配平);(乙)Mm++mOH-=M(OH)m↓。下列对两个离子反应通式的推断中,正确的是
①若n=1,则XO3n -中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
A. ①③ B. ②③ C. ①② D. ④⑤
【答案】B
【解析】试题分析:①n=1,XO3n中X元素为+5价,常见非金属元素中呈+5价的元素有第ⅤA族(氮、磷)、第ⅤⅡA族(氯、溴、碘)所以符合条件的酸根阴离子主要有:IO3-、ClO3-、BrO3-、NO3-,甲反应为ClO3-+5Cl-+6H+=3Cl2+3H2O,IO3-+5I-+6H+=3I2+3H2O,故①错误;②n=2,XO3n中X元素为+4价,常见非金属元素中碳、硅、硫有+4价,结合通式只有X为硫符合题意,离子方程式为:SO32-+2S2-+6H+=3S↓+3H2O,硫的最高价含氧酸为硫酸,氢化物为硫化氢,故②正确;③m=1,+1价阳离子有:Ag+、Na+、K+等,只有氢氧化银是难溶于水的沉淀;Ag++OH-=AgOH↓;氢氧化银溶于氨水,硝酸银溶液滴入氨水,生成银氨溶液无明显现象;将氨水滴入硝酸银溶液中 产生沉淀,继续滴加沉淀溶解,互滴顺序不同现象不同,故③正确;④m=2,硫酸亚铁中+2价铁在空气中易被氧化为+3价,其化学方程式为:FeSO4+2H2OFe(OH)2+3H2O;4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3![]() Fe2O3+3H2O Fe2O3+3H2SO4=Fe(SO4)3+3H2O 总反应为:12FeSO4+3O2
Fe2O3+3H2O Fe2O3+3H2SO4=Fe(SO4)3+3H2O 总反应为:12FeSO4+3O2![]() 2Fe2O3+4Fe2(SO4)3,即硫酸亚铁溶液经蒸干、灼烧得到硫酸铁和氢氧化铁混合物,故④错误;⑤m=3,常见金属中只有铁、铝符合条件,铝和过量氢氧化钠沉淀会溶解,故⑤错误;故选B。
2Fe2O3+4Fe2(SO4)3,即硫酸亚铁溶液经蒸干、灼烧得到硫酸铁和氢氧化铁混合物,故④错误;⑤m=3,常见金属中只有铁、铝符合条件,铝和过量氢氧化钠沉淀会溶解,故⑤错误;故选B。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
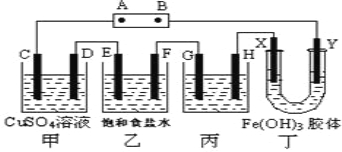
(1)电源B 极的名称是___________。
(2)甲装置中电解反应的总化学方程式是:_________________。
(3)设电解质溶液过量,则同一时间内C、D电极上参加反应的单质或生成的单质的物质的量之比是__________。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质)精炼,G极材料应该是__________(填“粗铜”或“精铜”),电解液中原电解质的物质的量浓度将__________(填“变大”、“变小”或“不变”)。
(5)设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.因为Na2CO3+SiO2![]() Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不和水反应生成硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
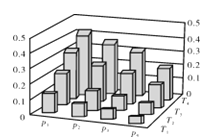
A. P1>P2>P3>P4
B. 甲醇的物质的量分数越高,反应的平衡常数越大
C. 若T1> T2> T3>T4,则该反应为放热反应
D. 缩小容积,可以提高CH3OH在混合物中的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用下图装置进行实验研究(a、b、c表示止水夹)。请评价或完善其方案:
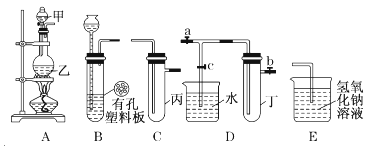
(1)将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①氯元素在周期表中的位置为 。
②A中反应的离子方程式: 。
③E中氢氧化钠溶液的作用 。
在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
实验序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
④实验Ⅰ推出的相应结论是否合理? ,若不合理,请说明理由(若合理,无需填写) 。
⑤实验Ⅱ推出相应的结论是否合理? ,若不合理,请说明理由(若合理,无需填写) 。
(2)将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2。B中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 1molL-1的Ca(HCO3)2溶液中,放入2.3g金属钠充分反应后,有关物质的物理量正确的是(NA表示阿伏加德罗常数)
生成CaCO3 | 溶液中HCO3- | H2 | 转移的电子 | |
A | 0.1NA | 0.1NA | ||
B | 1.12L | 0.1NA | ||
C | 10g | 0.05NA | ||
D | 10g | 0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述不正确的是
A.常温常压下,17g甲基(—14CH3)所含的中子数为8NA
B.0.1molFe与0.1molCl2充分反应,转移的电子数为0.2NA
C.标准状况下,44.8LNO与22.4LO2混合后气体的分子总数为2NA
D.1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构如下图所示,下列说法正确的是( )
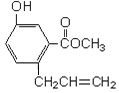
A.一定条件下和浓溴水反应时,1 mol A能消耗3 mol Br2
B.一定条件下,1 mol A能和5 mol氢气发生加成反应
C.一定条件下,1 mol A能与3 mol NaOH反应
D.A能与碳酸氢钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝和铁是中学化学常见的三种重要金属.请回答下列问题:
(1)钠在空气中燃烧生成淡黄色的 (填“Na2O”或“Na2O2”)
(2)Al2O3能溶于酸或强碱溶液生成盐和水,则Al2O3是一种 (填“酸性”、“碱性”或“两性”)氧化物
(3)Fe(OH)3不溶于水,但能溶于酸.请写出Fe(OH)3与盐酸反应的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com