
| A、用小苏打(NaHCO3)治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| B、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| C、往氢氧化钠中滴加氯化铜溶液:Cu2++2OH-=Cu(OH)2↓ |
| D、铜片插入硝酸银溶液:Cu+Ag+═Cu2++Ag |


科目:高中化学 来源: 题型:
| A、①②⑤ | B、②④ |
| C、①②③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 | B、氢氧化钾溶液 |
| C、氯化钡溶液 | D、硫酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鉴别食盐和小苏打 |
| B、检验食盐中是否含KIO3 |
| C、检验自来水中是否含有氯离子 |
| D、检验白酒中是否含甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
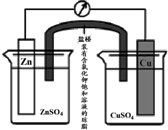
| A、在外电路中,电流从Zn极流向Cu极 |
| B、盐桥中的Cl-移向CuSO4溶液 |
| C、当负极减小65g时,正极增加65g |
| D、电池的总反应为 Zn+Cu2+=Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将Cu片放入浓H2SO4中 | 生成刺激性气味气体 | Cu与浓H2SO4反应生成SO2 |
| B | Al2(SO4)3溶液中滴加过量氨水 | 生成白色胶状物质 | Al(OH)3不溶于氨水 |
| C | 氯气通入湿润的红色布条 | 红色布条褪色 | 氯气具有漂白性 |
| D | 向某溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 该溶液中存在I- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1,则H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=2×(-57.3)kJ?mol-1 | ||||
| B、已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ?mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | ||||
C、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
| ||||
D、葡萄糖的燃烧热是2 800 kJ?mol-1,则
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在2mL10%的氢氧化钠溶液中滴入2%的硫酸铜溶液4~6滴,配制新制氢氧化铜悬浊液,检验醛基 |
| B、实验室制乙烯时,迅速升温到140℃ |
| C、用乙醇和浓硫酸除去乙酸乙酯中混有的少量乙酸 |
| D、用苯、2mol/L的硝酸和3mol/L的硫酸制硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
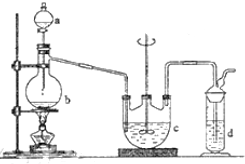 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com