
【题目】下列提纯方法不正确的是( )
A.除去KNO3中的NaCl杂质----结晶.
B.除去食盐中的泥沙-----过滤
C.除去KCl中的K2CO3-----加适量盐酸
D.除去CaCO3中的CaO-----高温
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]有机物F是一种香料,其合成路线如图所示:
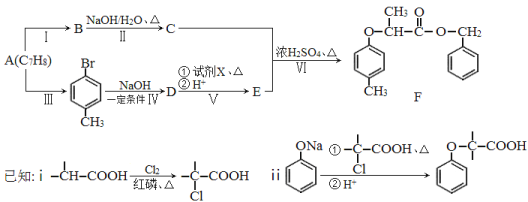
(1)A的名称为 ,试剂X的结构简式为 ,步骤Ⅵ的反应类型为 。
(2)步骤Ⅰ的反应试剂和条件分别为 、 。
(3)步骤Ⅱ反应的化学方程式为 。
(4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有 种,其中核磁共振氢谱峰面积比为6︰2︰2︰1︰1的分子的结构简式为 。
(5)依据题中信息,完成以![]() 为原料制取
为原料制取 的合成路线图。
的合成路线图。
合成路线图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生物体内化学元素的叙述,错误的是( )
A.同一生物体不同组织细胞内化学元素种类和含量大体相同
B.C、H、O、N是组成生物体内酶所必需的元素
C.蛋白质中的S元素存在于氨基酸的R基中
D.占细胞的鲜重最多的元素是O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某城市某日空气质量报告:
污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
实验一:用下图所示装置进行实验。

(1)A装置的作用是_________(填“干燥”或“氧化”)SO2气体。
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变_______色(填“蓝色”或“红色”或“不变色”),说明SO2与水反应生成一种酸。
(3)D装置的作用是_________ ,并写出化学反应方程式_____________________。
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH_______7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4。
(查阅资料) SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作_________(填“催化剂”或“氧化剂”)。
(探究结论)SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(知识联想)
(1)酸雨造成的危害是:______________________________(举一例)。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为____________,是造成酸雨的另一主要原因。
(提出建议)该市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加人_________(填“水”或“乙醇”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)丙烷(C3H8)是一种价格低廉的常用燃料,其主要成分是碳和氢两种元素,燃烧后只有二氧化碳和气态水,不会对环境造成污染。已知1 g丙烷完全燃烧放出50.45 kJ的热量。丙烷在室温下燃烧的热化学方程式为。
(2)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为;
(3)一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生反应N2O4 (g) ![]() 2NO2 (g) ,下列示意图正确且能说明反应达到平衡状态的是。
2NO2 (g) ,下列示意图正确且能说明反应达到平衡状态的是。
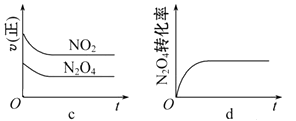
(4)在密闭容器中充入A(g)和B(g),它们的初始浓度均为2 mol·L-1 , 在一定条件下发生反应:A(g)+B(g) ![]() 2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
①该反应的平衡常数的表达式为。
②A的转化率为。
③若升温至T2时,此反应的平衡常数为1,判断该反应ΔH0(填“>”或“<”);若在T2时,投入A、B、C三种物质的浓度均为3 mol·L-1 , 此时v(正)v(逆)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的办法。塑料袋、废纸、旧橡胶制品等属于
A. 无机物 B. 非金属单质 C. 纯净物 D. 有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
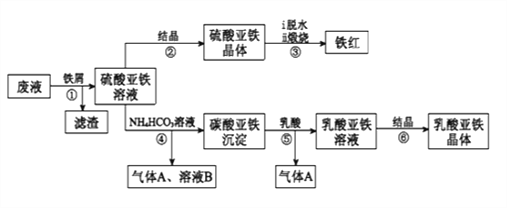
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_________________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________。
(5)步骤④的离子方程式是_________________________________________。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______________(用a表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com