


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:2013届北京市西城区高三上学期期末考试化学试卷(带解析) 题型:填空题
(12分)脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是_______。
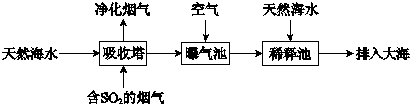
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:
①向曝气池中通入空气的目的是_______。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是_______。
a.Cl- b.SO42- c.Br- d.HCO3-
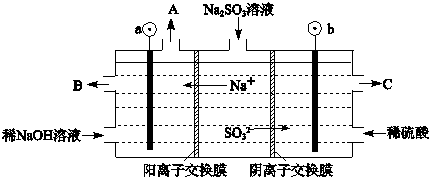
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。
②SO32-放电的电极反应式为_______。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因_______。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三上学期期末考试化学试卷(解析版) 题型:填空题
)2013年全国各地连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害,因此研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.脱硫技术能有效控制SO2对空气的污染。
(1)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、CI-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:

①向曝气池中通入空气的目的是 ???????????????????????
②通入空气后曝气池中海水与天然海水相比,浓度没有明显变化的离子是??? 。
a.Cl-? B.SO42-? C.HCO3-
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)

①图中b极要连接电的(填“正”或“负”) ?? 极,C口流出的物质是? ?????? 。
②SO32-放电的电极反应式为???????????????????????? ??
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 ?? ? 。
II.我国的能消费结构以燃煤为主,将煤气化可减少环境污染,但煤气化过程中能产生有害气体H2S,用足量的Na2CO3溶液可吸收,该反应的离子方程式为 ? 。
(已知:H2S Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3? Kal=4.30×10-7;Ka2=5.61 ×10-11)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市西城区高三上学期期末考试化学试卷(解析版) 题型:填空题
(12分)脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是_______。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:

①向曝气池中通入空气的目的是_______。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是_______。
a.Cl- b.SO42- c.Br- d.HCO3-
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)

①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。
②SO32-放电的电极反应式为_______。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com