
【题目】溶液X可能含有Na+、Fe3+、Ca2+、SO42-、 CO32- 、Cl-、I-中的几种离子。为确定其组成,设计并完成以下实验:

根据上述实验,以下推测合理的是
A. 溶液X中是否存在Na+还需要通过焰色反应进一步确认
B. 溶液X中一定不含Fe3+、Ca2+、SO42-
C. 为确定溶液X中是否含有Cl-,可取溶液2加入CCl4充分萃取后,再取上层液体加入AgNO3溶液
D. 溶液X的溶质为Na2CO3和NaI
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

A. 原混合溶液中的CO2-3与AlO-2的物质的量之比为1:2
B. V1:V2=1:5
C. M点时生成的CO2为0.05mol
D. a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的说法正确的是( )
A. 原电池是将电能能转化为化学能的装置 B. 原电池负极发生氧化反应
C. 原电池中,阳离子向负极移动 D. 原电池电子流出的一极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:
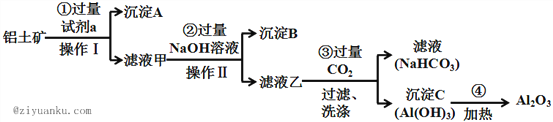
(1)沉淀A的成分是(填化学式)_________。
(2) 步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3) 步骤③中通入过量CO2气体而不加入过量盐酸的理由是___________________;
(4) 准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为_________。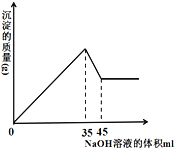
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据以下信息判断,分离乙醇、乙二醇混合物的最佳方法是( )
熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 | |
乙醇 | -114 | 78 | 0.79 | 与水以任意比例互溶 |
乙二醇 | -13 | 197 | 1.11 | 与水以任意比例互溶 |
A.分液B.用水萃取C.蒸馏D.重结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在c(Na2CO3)+c(NaHCO3)=0.100mol·L-1的混合溶液中,c(HCO3-)、c(CO32-)与pH的关系如下图所示。下列说法正确的是

A. pH=10的溶液中:c(HCO3-)<c(CO32-)
B. E点溶液中:c(Na+)=3c(CO32-)
C. pH=11的溶液中:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(CO32-)+0.100mol·L-1
D. 在E点溶液中加入等体积0.100mol·L-1的NaOH溶液,c(CO32-)与c(HCO3-)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中,硝酸既表现了氧化性,又表现了酸性的是
A. C+HNO3 B. NH3+HNO3 C. Fe(OH)3+HNO3 D. Cu+HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把![]() L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用
L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用![]() mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗![]() molBaCl2,则原溶液中
molBaCl2,则原溶液中![]() (NO
(NO![]() )为( )
)为( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·1-1
mol·1-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL2mol/L的硫酸和过量的锌片反应,为了加快反应速率,但又不影响生成氢气的总量,不宜采取的措施是
A. 改用锌粉 B. 升温反应体系的温度
C. 加入少量的CuSO4溶液 D. 改用200mLlmol/L的硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com