
 如图为1mol甲烷在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中正确的是( )
如图为1mol甲烷在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中正确的是( )| A、甲烷燃烧为吸热反应 |
| B、甲烷的燃烧热△H=-802kJ?mol-1 |
| C、EA-EB=1015kJ |
| D、该反应的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802kJ?mol-1 |


科目:高中化学 来源: 题型:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | -2 | -4 | -2 | -3 | -1 | -3 | -4 | -1 |
| A、A的氢化物比C的氢化物稳定 |
| B、F的氢化物与H的氢化物化合所得产物为离子晶体 |
| C、F、G、H的最高价氧化物对应的水化物的酸性依次增强 |
| D、B和G的最高价氧化物均为原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属腐蚀就是金属原子失去电子被还原的过程 |
| B、合金都比纯金属易被腐蚀 |
| C、将金属与外加直流电源的负极相连,而将正极接到废铁上,可以防止金属被腐蚀 |
| D、镀锌铁比镀锡铁更容易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
| B、标准状况下,22.4 L NH3中含有共价键的数目为NA |
| C、1 molCl2与足量Fe反应转移电子数一定为3NA |
| D、标准状况下,11.2 L SO3所含的分子数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,含NA个氧分子的氧气的体积小于22.4L |
| B、2.24LCl2与足量Ca(OH)2反应,转移的电子数为0.1NA |
| C、1mol CH3OH在燃料电池负极反应时转移的电子数是6NA |
| D、100mL 18 mol/L浓硫酸与足量铜共热,可生成SO2的分子数为0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应中的能量变化,通常表现为热量的变化 |
| B、煤和石油属于可再生能源 |
| C、要使燃料燃烧只需要大量的氧气 |
| D、汽车排出大量尾气中含有CO会污染大气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | ||
| B、用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | ||
| C、苯酚与纯碱溶液混合:2C6H5OH+CO32-→CO2↑+H2O+2C6H5O- | ||
D、甲醛溶液与足量的银氨溶液共热HCHO+4Ag(NH3)2++4OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
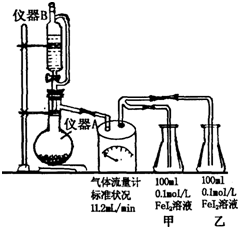 某研究性学习小组为探究Cl2的氧化性和I-的还原性强于Fe2+,设计了如图装置制取Cl2,并进行实验探究.回答下列问题:
某研究性学习小组为探究Cl2的氧化性和I-的还原性强于Fe2+,设计了如图装置制取Cl2,并进行实验探究.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com