
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2004全国各省市高考模拟试题汇编·化学 题型:058
实验室可用氯化钙固体和碳酸钠溶液等试剂,制取一定量纯净的硝酸钙晶体.
(1)写出制取过程中反应的离子方程式
________.
(2)简述实验操作步骤(不要求回答使用的仪器,但要求回答试剂的用量,如少量、适量或过量)
A.用蒸馏水完全溶解CaCl2后,加入________.
B.将反应后的溶液过滤,并用________洗涤沉淀至无Cl-.
C.加入________,使沉淀完全溶解.
D.________.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
Ⅰ)纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
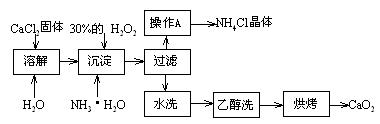
根据以上信息,回答下列问题:
⑴用上述方法制取CaO2·8H2O的化学方程式是_▲_;
⑵测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取ag产品于锥形瓶中,加入适量蒸馏水和过量的bgKI品体,再滴入适量2mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为 ▲ ;
②产品中CaO2的质量分数为 ▲ (用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示) ▲ 。
Ⅱ)硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
⑴工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式_ ▲ _;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 ▲ 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 ▲ 。
⑵测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5: ▲ ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物。取25.0gCuSO4·5H2O晶体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:
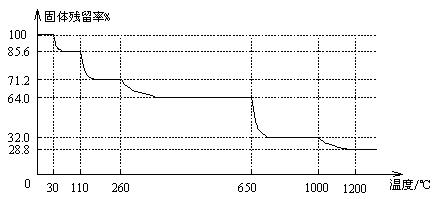
在110℃时所得固体的成分为 ▲ ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为 ▲ 。(填字母)
A.0mol B.0.1mol C.0.125mol D.大于0.125mol
查看答案和解析>>
科目:高中化学 来源: 题型:
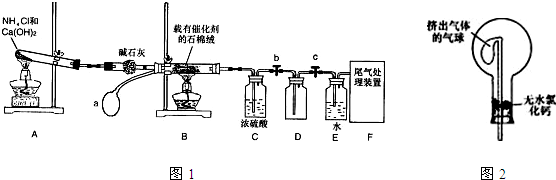
某化学小组模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。
请回答下列问题:
(1)写出装置A中主要反应的化学方程式 。
(2)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是
(3)装置C中浓H2SO4的作用是 。
(4)请你帮助该化学小组设计实验室制取NH3的另一方案
(5)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计右图所示装置(仪器固定装置省略未画)进行验证。实验步骤如下:
①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞。
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是 ,由此,该同学得出结论:不能用CaCl2代替碱石灰。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com