
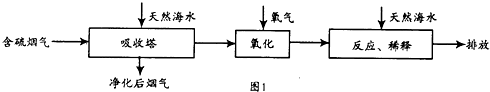
| 实验序号 | 温度(K) | 含硫烟气SO2浓度(10-6mol.l-1) | 脱硫率(%) |
| Ⅰ | 298 | 400 | 99.5 |
| Ⅱ | T | 500 | 97.1 |
| Ⅲ | 313 | 400 | 94.3 |
| 1000 |
| 20 |
| 72mg |
| 16L |
| ||
| ||


科目:高中化学 来源: 题型:022
烟道气中SO2可以用消石灰处理而除去,其反应方程式为:2Ca(OH )2+2SO2+O2=2H2O+2CaSO4,为了除去烟道气中1kg SO2,需0.01mol/L的Ca(OH )2溶液_______________L。
查看答案和解析>>
科目:高中化学 来源: 题型:038
烟道气中SO2可以用消石灰处理而除去,其反应方程式为:2Ca(OH)2+2SO2+O2═══2H2O+2CaSO4。为了除去烟道气中0.64kgSO2,需要0.01mol•L-1的Ca(OH)2溶液多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:
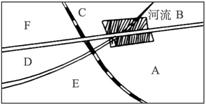
图5-12
(1)若该厂以含硫质量分数为2%的重油为燃料,假设1 dm3重油(密度为0.95 g·cm-3)燃烧生成14 m3标准状况下的烟道气,计算烟道气中SO2的体积分数。
(2)请在图5-12中A、B、C、D、E、F处选一最佳建厂处,说明理由。
(3)请你预测此工厂将有哪些方面对环境造成污染?
(4)请你用物理、化学、生物等方面的知识设计一个保护环境、控制污染的方案。
(5)以含硫3.5%的重油为燃料,重油使用量为0.18 dm3(kW·h)-1,该厂开工率为(每年实际运转天数)为80%,对烟道气的脱硫回收的SO2能生产多少千克(NH4)2SO4或生产石膏(CaSO4·2H2O)多少千克?若将这些SO2制成70%的浓硫酸,可生产这种浓硫酸多少千克?
查看答案和解析>>
科目:高中化学 来源: 题型:
为测定某工厂烟道气中SO2的含量,使16.00L烟道气缓慢通过1L水,设SO2完全被吸收,且溶液体积不改变。取出其中20.00mL溶液,加入2—3滴淀粉溶液后,用1.18×10-3mol/L的饱和碘水(密度为1g/cm3)滴定,耗去19.07mL达到终点。(反应为SO2+I2+2H2O→H2SO4+2HI)求
(1)实验条件下碘的溶解度;
(2)该厂烟道气中SO2的含量(mg/L);
(3)为简便计算,在其余操作都不变的情况下,要使滴定时每水泵5mL碘水相当于烟道气中含SO21mg./L,则所配制的碘水的物质的量浓度为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com