
| X | |||
| Y | Z | W |
| A、原子半径:X>Z>Y |
| B、Z的最高价氧化物能与NaOH,HF反应,但不是两性氧化物 |
| C、最高价氧化物对应水化物的酸性:Z>W |
| D、X与O元素和H元素形成的化合物一定是共价化合物 |


科目:高中化学 来源: 题型:
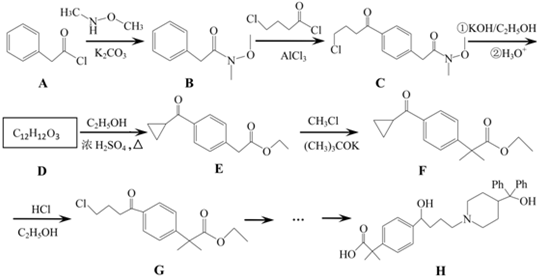
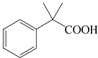 是一种重要的有机合成中间体,请完成以苯乙烯为主要原料(其他试剂自选)合成该化合物的合成路线流程图.合成路线流程图示例如下:H2C=CH2
是一种重要的有机合成中间体,请完成以苯乙烯为主要原料(其他试剂自选)合成该化合物的合成路线流程图.合成路线流程图示例如下:H2C=CH2| Br |
| NaOH溶液 |
 →
→查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容及现象 | 实验结论 | |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出 | 两份蛋白质溶液均发生变性 |
| B | 向某溶液中滴加KSCN溶液,无明显现象,滴加氯水后,溶液变红 | 说明溶液中含有Fe2- |
| C | 向BaSO4悬浊液中加入饱和Na2CO3溶液,发现有BaCO3生成 | 说明Ksp(BaSO4)Ksp(BaCO4) |
| D | 将苯滴入溴水中,震荡,静置,溴水层褪色 | 溴和苯发生加成反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次序编号 | 盐酸溶液体积V/mL | 氢氧化钠溶液体积V/mL |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 25.00 | 10.00 |
| 4 | 20.00 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用过滤的方法除去食盐水中的泥沙 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用酒精萃取碘水中的碘 |
| D、用加热的方法除去苏打中的小苏打 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,将5.6L的O2和5.6LNO的混合后的分子数约为0.5NA |
| B、2L 0.5mol/L BaCl2溶液中,阳离子所带电荷数为 NA |
| C、常温常压下,将0.2mol铝片投入含0.6molH2SO4的浓硫酸中,生成0.3 NA个SO2分子 |
| D、42g丙烯气体中,含有的σ键数目为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M |
| B、M+ |
| C、M2+ |
| D、M3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、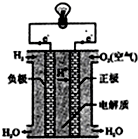 如图表示氢氧燃料电池构造示意图 |
B、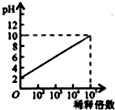 如图表示室温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 |
C、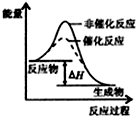 如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
D、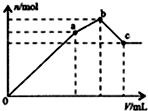 如图表示向NH4 Al(S04)2溶液中逐滴滴人Ba(OH)2溶液,生成沉淀总物质的量(n)随 着Ba(OH)2溶液体积(y)的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com