
【题目】向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如下图所示。下列说法中正确的是( )
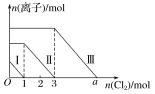
A.线段Ⅲ代表Fe2+的变化情况
B.线段Ⅰ代表Br-的变化情况
C.a值等于6
D.原混合溶液中n(FeBr2)=4mol
【答案】C
【解析】
向仅含Fe2+、I-、Br-的溶液中通入适量氯气,还原性I->Fe2+>Br-,首先发生反应2I-+Cl2=I2+2Cl-,I-反应完毕,再反应反应2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,最后发生反应2Br-+Cl2=Br2+2Cl-,故线段I代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况;由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,据此分析作答。
A.由上述分析可知,线段Ⅲ代表Br-的变化情况,A项错误;
B.由上述分析可知,线段I代表I-的变化情况,B项错误;
C.由上述分析可知,溶液中n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据2Br-+Cl2=Br2+2Cl-可知,溴离子反应需要的氯气的物质的量为3mol,故a=3+3=6,C项正确;
D.由上述分析可知,n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,而n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,则原混合溶液中n(FeBr2)=![]() n(Br-)=3mol,D项错误;
n(Br-)=3mol,D项错误;
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】科学家预言自然界中可能存在原子序数为114号的稳定同位素![]() X,根据原子结构理论和元素周期律下列预测错误的是
X,根据原子结构理论和元素周期律下列预测错误的是
A.![]() X位于第七周期,第ⅣA 族B.X是金属元素
X位于第七周期,第ⅣA 族B.X是金属元素
C.XO2是酸性氧化物D.X元素的化合价有+2和+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
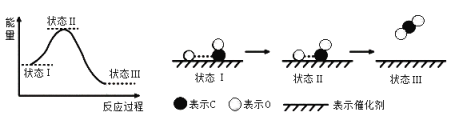
下列说法中正确的是
A.在该过程中,CO断键形成C和O
B.CO和O生成了具有共价键的CO2
C.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
D.CO和O生成CO2是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO

(1)试剂X为___________________________。
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是___(填编号)。若测定结果偏高其原因可能是__(填字母)。
A.配制标准溶液的固体NaOH中混有Na2O杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是___。
(3)如图是某次滴定时滴定管中的液面,其读数为___mL。
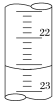
(4)根据下列数据,请计算待测盐酸的浓度:___molL-1。
滴定次数 | 待测体积(mL) | 标准NaOH溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以海水晒盐后的苦囟![]() 含有
含有![]() 为原料,设计制备碘单质
为原料,设计制备碘单质![]() 的转化途径如图,下列说法不正确的是
的转化途径如图,下列说法不正确的是

A.生活中可直接使用![]() 淀粉试纸检验加碘盐中是否含有碘
淀粉试纸检验加碘盐中是否含有碘
B.途径Ⅲ发生反应的离子方程式可能是![]()
C.由图可知氧化性的强弱顺序为![]()
D.两种途径得到等量的碘,消耗氯气物质的量比为1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期律(表)是认识元素化合物性质的重要理论。
(1)某学习小组研究了金属锂、钠、镁的性质后发现:
ⅰ.锂、镁和水反应均较为微弱,钠和水反应较为剧烈
ⅱ.锂和镁的氢氧化物均为中等强度的碱
ⅲ.锂、镁在空气中燃烧均生成氧化物,而钠在空气中燃烧生成过氧化物
根据以上事实,可知锂、钠、镁三种元素的金属性强弱关系是___________________(用“>”“=”或“<”)。
(2)锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
①碱性:Sr(OH)2_____ Ba (OH)2(填“>”或“<”)。
②用原子结构的观点解释锶的化学性质与钡差异的原因:______________________________
(3)硒(Se)的部分信息如图,且知34Se、35Br位于同一周期。
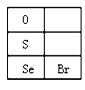
①Se在元素周期表中的位置是_______________。
②H2Se的电子式是______________。
③Cl、Se、Br的非金属性强弱的顺序是__________________;能证明上述强弱关系的事实是____________________________(写出一条即可)。
④某同学对SeO2(白色的挥发性固体,易溶于水)的各种不同化学性质进行推测,并用SO2水溶液、H2O2溶液、NaOH溶液、稀H2SO4等试剂进行实验,证明了推测是正确的。完成下表:
编号 | 性质推测 | 化学方程式 |
1 | 氧化性 | SeO2+2SO2+2H2O=Se+2H2SO4 |
2 | ____________ | ______________ |
3 | ___________ | ____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配合离子![]()
C.![]() 比
比![]() 中的配位键稳定
中的配位键稳定
D.用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.将5.85gNaCl晶体溶入100mL水中,制得0.1mol/LNaCl溶液
B.将1体积cmol/L硫酸溶液用水稀释为5体积,得到0.2cmol/L硫酸溶液
C.将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L
D.将wga%NaCl溶液蒸发掉![]() g水,一定得到2a%NaCl溶液
g水,一定得到2a%NaCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com