
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
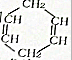 可简写为
可简写为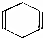 .现有某化合物w的分子结构可表示为
.现有某化合物w的分子结构可表示为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
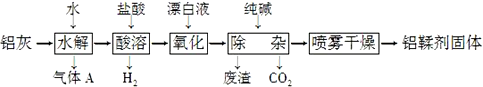
| A. | 气体A能使湿润的红色石蕊试纸变蓝 | |
| B. | “水解”采用90℃而不在室温下进行的原因是加快AlN的水解和使氨气溢出 | |
| C. | “废渣”成分为Al(OH)3和Fe(OH)3 | |
| D. | 采用喷雾干燥而不用蒸发的原因是防止Al(OH)2Cl水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 过程①中,FeS和O2、H2SO4反应的化学方程式是4FeS+3O2+6H2SO4═2Fe2(SO4)3+6H2O+4S | |
| B. | 过程②中产生的气体会对大气造成污染,可选用氢氧化钠溶液吸收 | |
| C. | 过程③中,需要加入的物质名称是稀硫酸 | |
| D. | 过程④中的实验操作是蒸发浓缩、冷却结晶、过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
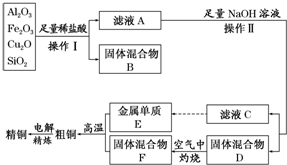
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=1的溶液中:Na+、ClO-、SO42-、I- | |
| B. | 由水电离的c(H+)=l×l0-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | 既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、CO32-、SO32-、NO3 | |
| D. | 无色透明的溶液中:K+、Cu2+、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大到小:Z>Y>X>W | B. | 阴离子的还原性:Y>Z | ||
| C. | 氢化物的沸点:Y>X | D. | 氧化物对应水化物的酸性:Y<Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com