
分析 (1)能够构成原电池的反应必须是自发的氧化还原反应;
(2)根据反应“2FeCl3+Cu=2FeCl2+CuCl2”可知,反应中铜失电子而被氧化,应为原电池负极,正极应为活泼性比铜弱的金属或导电的非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,依次分析解答;
(3)根据原电池的电极反应式判断电极质量减少的物质,再结合方程式计算生成气体的体积.
解答 解:(1 )能够构成原电池的反应必须是自发的氧化还原反应,NaOH与HCl 的中和反应不是氧化还原反应,不能设计成原电池,
故答案为:否;该中和反应是非氧化还原反应,能够构成原电池的反应必须是自发的氧化还原反应;
(2)①由反应“2FeCl3+Cu=2FeCl2+CuCl2”可知,反应中铜失电子而被氧化,应为原电池负极,正极应为活泼性比铜弱的金属或导电的非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,
故答案为:石墨;铜;FeCl3溶液;
②负极上铜失电子发生氧化反应,正极上铁离子得电子发生还原反应,其电极反应式为:负极:Cu-2e-=Cu2+正极:2Fe3++2e-=2Fe2+,
故答案为:Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+.
③原电池中,外电路中的电子是从负极流向正极,即从Cu电极流向石墨电极,故答案为:Cu;石墨;
(3)银片和锌片分别作原电池的正负极,当发生反应时,负极材料失电子变成离子进入溶液,质量减少;正极材料不参加反应,所以本题质量减少的量是锌的质量.
锌减少的质量为60g-47g=13g,结合方程式计算生成氢气的体积.
Zn+H2SO4=ZnSO4 +H2↑
65g 22.4L
13g 4.48L
即产生氢气的体积为4.48L.
故答案为:4.48L.
点评 本题考查原电池的设计及原电池的工作原理,题目难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | 由金属A和金属B构成的原电池,电子由A流向B | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | 常温时,A能从酸中置换出氢,而B不能 |
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:填空题
【选做题——物质结构与性质】
早期发现的一种天然二十面体准晶颗粒由 Al、Cu、Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有个___________个未成对电子。Fe3+的电子排布式为_____________ 。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为__________,1 mol乙醛分子中含有的σ键的数目为______________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___________个铜原子。锗也是一种半导体材料,Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键,从原子结构角度分析,原因是_______________________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图

镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=_____________(填数值);氢在合金中的密度为_____________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,共转移NA个电子
B.标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA
C.标准状况下,11.2 L HF含有0.5 NA个HF分子
D.500mL 12mol.L-1的盐酸与足量 MnO2加热充分反应,生成Cl2 分子数目1.5 NA
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:填空题
氯化铜可用于生产颜料、木材防腐剂等.用粗铜(含杂质Fe)经过一系列步骤可制备氯化铜晶体(CuCl2•2H2O).完成下列填空:
(1)实验室用浓盐酸和二氧化锰共热来制备Cl2,写出该反应的离子方程式______________.
(2)加入试剂将CuCl2和FeCl3的混合溶液pH调至4~5,过滤得到纯净的CuCl2溶液,应加入的试剂是______________(填字母编号)
a.CuO b.NaOH c.Cu2(OH)2CO3 d.Cu
(3)CuCl2溶液通过蒸发、结晶可得到CuCl2•2H2O.
①蒸发过程中,加入盐酸的目的是______________.
②蒸发过程中,观察到溶液颜色由蓝色变为绿色.
其原理是: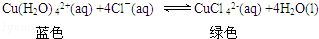
上述反应的化学平衡常数表达式是______________.
欲使溶液由绿色变成蓝色的措施是:a__________;b__________.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为相互串联的甲乙两电解池.试回答:
如图为相互串联的甲乙两电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
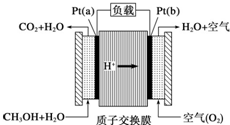
| A. | a 是负极,b 是正极 | |
| B. | b 极的电极反应是O2+4H++4e-=2H2O | |
| C. | 放电过程中,电子流动方向为:a→b→质子交换膜→a | |
| D. | 当电路上通过2 mol 电子消耗的CH3OH 为1/3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
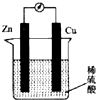
| A. | 锌为负极.锏为正极 | |
| B. | 铜片上有大童气泡生成 | |
| C. | 电流由锌片经导线流向铜片 | |
| D. | 当反应过程中有0.2 mol电子发生转移时,生成了 2.24 L氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com