
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| C. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| D. | 金属氧化物一定不能与碱发生反应 |
分析 A.纯碱为碳酸钠,属于盐;
B.依据电解质、非电解质、强电解质、弱电解质的概念判断;
C.根据金属的活泼性来判断冶炼方法;
D、金属氧化物有的能与碱发生反应.
解答 解:A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、盐、盐和氧化物,故A错误;
B.蔗糖在水溶液中或熔融状态下均不导电属于非电解质;硫酸钡在溶液中完全电离属于强电解质;水能够发生部分电离属于弱电解质,故B正确;
C.Mg、Al活泼性较强工业上利用电解法冶炼,Cu用热还原法冶炼,故C错误;
D、氧化铝是金属氧化物,能和强碱之间反应,故D错误.
故选B.
点评 本题属于基本概念的考查,题目难度不大,注意把握电解质、非电解质、酸、碱、盐的概念.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
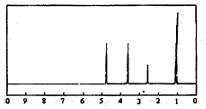
| A. | A分子属于酯类化合物 | |
| B. | A在一定条件下可与H2发生加成反应 | |
| C. | 符合题中A分子结构特征的有机物只有一种 | |
| D. | 与A属于同类化合物的同分异构体只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥⑦ | B. | ①③④⑤ | C. | ②④⑤ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠 | |
| B. | 为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂 | |
| C. | 服用阿斯匹林后出现胃肠道反应是中毒的表现,应立即停药 | |
| D. | 为保证人体所需足够蛋白质我们要多吃肉,少吃蔬菜和水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
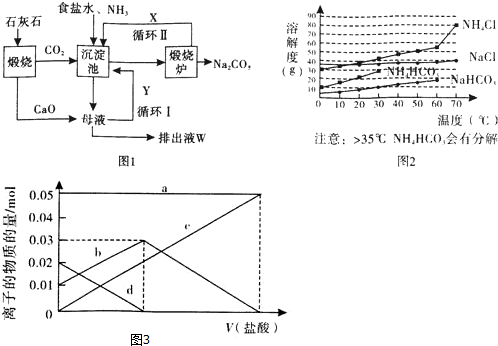
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
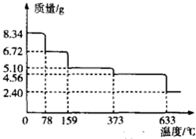 铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:
铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | x | Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com