
下列物质属于电解质的是
A.铜 B.稀硫酸 C.二氧化碳 D.熔融氯化钠
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源:2014-2015内蒙古赤峰市宁城县高二上学期期末考试化学试卷(解析版) 题型:填空题
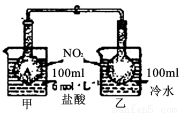
(1)如图所示,烧杯甲中盛放100 mL 6 mol·L-1的HCl溶液,烧杯乙中盛放100 mL冷水,现向烧杯甲的溶液中放入NaOH固体,同时向烧杯乙中放入NH4NO3固体,搅拌使之溶解。A瓶中气体颜色变深,B瓶气体颜色变浅,理由是: 。
(2)在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如下图。
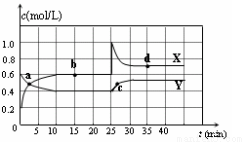
①图中的两条曲线,表示NO2浓度随时间的变化曲线
②前10 min内用υ(N2O4)表示的化学反应速率为
③25 min时,NO2转变为N2O4的反应速率增大,其原因是
④15min时的平衡常数为 ,35min时的平衡常数为 。
⑤在一定容积的密闭容器中,不能说明2NO2(g) N2O4(g)达到平衡状态的是( )
N2O4(g)达到平衡状态的是( )
A.容器的压强不再变化
B.容器的颜色不再变化
C.混合气体的平均相对分子质量不再变化
D.混合气体的密度不再变化
E.υ(NO2)=2υ(N2O4)
F.c(NO2)=2 c(N2O4)
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省扬州市高二上学期期末化学(必修)试卷(解析版) 题型:选择题
下列关于Na2CO3和NaHCO3的说法中不正确的是
A.可用澄清石灰水鉴别这两种物质
B.Na2CO3比NaHCO3更稳定
C.相同条件下0.5 mol/L Na2CO3溶液碱性比NaHCO3强
D.等物质的量的Na2CO3和NaHCO3与足量盐酸反应生成的二氧化碳质量相等
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省扬州市高二上学期期末化学(必修)试卷(解析版) 题型:选择题
下图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。

则该物质不具有的性质是
A.使紫色石蕊变红 B.与钠反应
C.发生酯化反应 D.发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省枣庄市高一上学期期末化学试卷(解析版) 题型:填空题
(7分)生活中为了延长鲜花的寿命,通常会在花瓶中加入“鲜花保鲜剂”。下表是0.5L某种“鲜花保鲜剂”中含有的成分及含量,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.25 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.25 | 158 |
硝酸银 | 0.02 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是___ _____。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为:____ ___ mol·L-1。
(要求用原始数据书写出表达式,不需要化简)
(3)为了研究不同浓度的“鲜花保鲜剂”的保鲜功效,需配制多份不同物质的量浓度的溶液进行研究。现欲配制480mL某物质的量浓度的“鲜花保鲜剂”,所需的玻璃仪器有:烧杯、玻璃棒、________________、____________。(在横线上填写所缺仪器的名称)
(4)配制上述“鲜花保鲜剂”时,其正确的操作顺序是(用字母表示,每个操作只用一次): ;
A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入适量水溶解
C.将烧杯中的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
E.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
G.用电子天平称量各组成成分,并把它们放入烧杯中混合
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是:____ ______。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“鲜花保鲜剂”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省枣庄市高一上学期期末化学试卷(解析版) 题型:选择题
纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这种两种物质的方法正确的是
A.分别用炒锅加热两种样品,全部分解挥发,没有物质残留的是小苏打
B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生明显变化的是小苏打
C.两只小玻璃杯,分别加入少量两种样品,再加入等浓度等体积的食醋,产生气泡快的是小苏打
D.先将两样品配成溶液,分别加入澄清石灰水,无白色沉淀生成的是小苏打
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省遂宁市高三第二次诊断考试化学试卷(解析版) 题型:填空题
(14分)钨是我国丰产元素,也是熔点最高的金属,被誉为“光明使者”。用黑钨矿[FeWO4、MnWO4(W为+6价)]结合其它化工生产高纯钨的化工流程如下。已知H2WO4是不溶于水的弱酸,受热可分解生成氧化物。请回答下列有关问题:
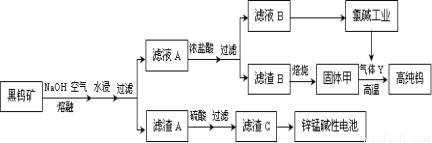
(1)上述流程中通入空气的目的是 ;
(2)滤渣A与硫酸反应的离子方程式为 ;
(3)实验室用锌锰碱性电池作做电源模拟氯碱工业的装置如下图:
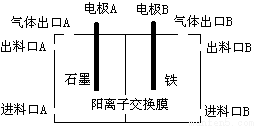
已知:锌锰碱性电池的总反应为Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,则锌锰碱性电池的锌电极应与装置中电极 (填“A”或“B”)相接,气体Y为气体出口 (填“A”或“B”)出来的气体,为提高生产效率,电解开始时,从进料口B加入的物质为 ,写出锌锰碱性电池正极反应式 ;
(4)已知:单质碳也可与固体甲制得钨,用气体Y而不用单质碳的原因 ;
(5)将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(1) ΔH2=-285.8 kJ/mol
H2O(1) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com