
【题目】用0.1 mol·L1的盐酸滴定20 mL约0.1 mol·L1氨水,滴定曲线如图所示,下列说法正确的是
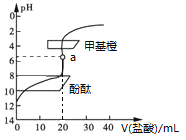
A. a点溶液中:c(H+)=c(OH)+c(NH3·H2O)
B. 滴定过程中,当溶液的pH=7时,两者恰好中和
C. 用酚酞作指示剂比用甲基橙作指示剂,滴定误差更小
D. 当滴入盐酸为30 mL时,溶液中:c(NH4+)+c(H+)<c(OH)+c(Cl)
【答案】A
【解析】A.a点时恰好中和生成氯化铵,物料守恒式为c(NH4+)+c(NH3H2O)=c(Cl-),电荷守恒式为c(NH4+)+c(H+)=c(OH-)+c(Cl-),则c(H+)=c(OH-)+c(NH3H2O),故A正确;B.两者恰好中和时生成氯化铵,溶液的pH<7,当溶液的pH=7时,氨水未完全反应,故B错误;C.反应终点生成氯化铵,水解显酸性,酚酞的变色范围为8~10,应选甲基橙作指示剂,即用酚酞作指示剂比用甲基橙作指示剂,滴定误差更大,故C错误;D.溶液不显电性,遵循电荷守恒,则当滴入盐酸达30mL时,溶液中c(NH4+)+c(H+)=c(OH-)+c(Cl-),故D错误;故选A。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)硅元素基态原子的价电子轨道表示式为____________。
(2)第四周期中,与铝未成对电子数相同的金属元素有________种。
(3)Na+和Ne互为等电子体,电离能I2(Na)________I1(Ne)(填“>”或“<”)。
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
化学式 | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
HClO4的结构简式为_________,HClO3中Cl原子的杂化轨道类型为________,HClO2中含有的共价键类型为__________。以上几种含氧酸的酸性强弱不同,其原因为______________。
②氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为_________,影响ΔH2递变的因素为______________。

(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA。则铝单质的密度为________g·cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是
A. 放电时,Li+在电解质中由负极向正极迁移
B. 充电时,若转移1mole-,石墨C6电极将增重7xg
C. 放电时,负极的电极反应式为LixC6-xe-= xLi++ C6
D. 充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①写出重晶石的化学式:____________;
②写出甘油的结构简式:____________。
(2)写出FeCl3与KI反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法中正确的是( )
A. 5NH4NO3 ![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2,转移的电子数目为3.75NA
B. 常温常压下,ag某气体含分子数为b,则cg该气体的体积为![]()
C. 2mol/L的CaCl2溶液中Cl-的数目为4NA
D. 46g NO2和N2O4的混合气体中含有的氧原子个数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,下列说法正确的是( )
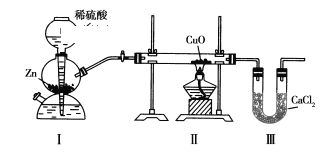
A. 若实验测得m(H):m(O)>1:8,则导致这一结果的原因可能为Ⅱ装置中的CuO没有全部被还原
B. Ⅰ、Ⅱ装置之间缺少干燥装置
C. 该实验的操作顺序为:先点燃酒精灯,然后将氢气通入Ⅱ装置
D. Ⅲ装置后是否加入干燥装置,均不会对实验结果带来影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种新型的固体氧化物型燃料电池,装置如图所示,在两极上分别通入甲烷和空气,电解质是掺杂了 Y2O3的ZrO3固体。在高温熔融状态下能传导O2-。下列说法正确的是
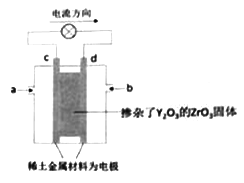
A. a处通入的甲烷
B. 工作时,在熔融电解质中,O2-离子移向d电极
C. c电极为正极,发生氧化反应
D. d电极的电极反应式:O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应2SO3(g)![]() 2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
A. 0~5min,O2的生成速率v(O2)=0.06mol·L-1·min-1
B. 若起始时充入3molSO3,起始时SO3分解速率不变
C. 若某时刻消耗了0.5molSO3同时生成了0.25molO2,则表明该反应达到了平衡状态
D. 达到平衡时,SO2和SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200℃和a℃时,反应X(g) ![]() 4Y(g)+Z(g)中X的浓度随时间变化的关系如图所示。
4Y(g)+Z(g)中X的浓度随时间变化的关系如图所示。
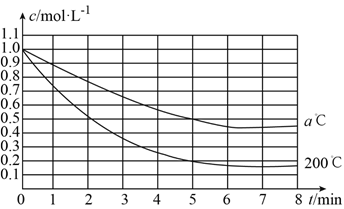
(1)200℃时5min内用Y表示的平均反应速率为__________。
(2)200℃、8min时,Z的浓度为__________。
(3)200℃时,在__________时,反应达到平衡状态。
(4)200℃、7min时,v正__________v逆(填“>”、“<”或“=”)。
(5)从图中可以看出,a__________200(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com