
| A. | 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3:2:1 | |
| B. | n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$ | |
| C. | 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32 | |
| D. | 5.6 g CO和22.4 L CO2中含有的碳原子数一定相等 |
分析 A、CO、CO2、O3三种气体,它们含有的氧原子个数之比为1:2:3,则氧原子的物质的量相同,设都为1mol,则n(CO)=1mol,n(CO2)=$\frac{1}{2}$mol,n(O3)=$\frac{1}{3}$mol,据此计算三种气体的物质的量之比;
B、ng Cl2的物质的量为$\frac{n}{71}$mol,所含氯原子数为:$\frac{n}{71}$×2NA,则有$\frac{n}{71}$mol×2NA=m,据此计算阿伏加德罗常数.
C、摩尔质量的单位是g•mol-1;
D、状况不知无法求体积.
解答 解:A、CO、CO2、O3三种气体,它们含有的氧原子个数之比为1:2:3,则氧原子的物质的量相同,设都为1mol,则n(CO)=1mol,n(CO2)=$\frac{1}{2}$mol,n(O3)=$\frac{1}{3}$mol,则这三种气体的物质的量之比为1:$\frac{1}{2}$:$\frac{1}{3}$=6:3:2,故A错误;
B、ng Cl2的物质的量为$\frac{n}{71}$mol,所含氯原子数为:$\frac{n}{71}$×2NA,则有$\frac{n}{71}$mol×2NA=m,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$,故B正确;
C、摩尔质量的单位是g•mol-1,所以X气体的摩尔质量是32g•mol-1,故C错误;
D、气体的状况不知无法求二氧化碳的物质的量,故D错误.
故选B.
点评 本题考查物质的量的有关计算,题目难度不大,要注意物质的量与质量、体积、粒子数目、浓度的计算公式的运用.


科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | N2和H2 | C. | N2和CO2 | D. | H2和CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲基(-CH3)所含电子数为9NA | |
| B. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA | |
| C. | 标准状况下,B2H6(g)和C2H4的混合气体22.4 L,所含的电子数约为16NA | |
| D. | 在浓硫酸作用下,60g冰醋酸与足量无水乙醇反应生成乙酸乙酯的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
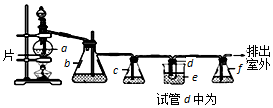
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①③④⑤ | C. | ①②③④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池工作时,电解质溶液H2SO4的浓度不变 | |
| B. | 加水稀释0.1 mol•L-1CH3COOH溶液时,CH3COOH的电离程度增大,pH减小 | |
| C. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 | |
| D. | 标准状况下,2.24 LCCl4含有的共价键数为0.4×6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )
工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )| A. | 电极Ⅱ为阳极,发生还原反应 | |
| B. | 通电后H+通过阳离子交换膜向电极Ⅰ方向移动,电极Ⅱ区溶液pH增大 | |
| C. | 阴极区电极反应式为:2SO2+2e-═S2O42- | |
| D. | 若通电一段时间后溶液中H+转移0.1mol,则处理标准状况下SO2废气2.24L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com