
分析 Fe与硫酸反应生成氢气,加少量硫酸铜,Fe可置换出Cu,构成原电池加快反应速率,或利用HgSO4代替硫酸铜,均为Fe作负极,且温度、浓度等均可加快反应速率,以此来解答.
解答 解:(1)实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu;Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是置换出的铜与锌在硫酸中构成原电池,加快反应速率,
故答案为:置换出的铜与锌在硫酸中构成原电池,加快反应速率;
(3)Na、K、Mg均比Fe活泼,不能发生置换反应,与上述实验中CuSO4溶液起相似作用的只有HgSO4,
故答案为:HgSO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升温、适当增大酸的浓度等,
故答案为:升高;适当增大酸的浓度.
点评 本题考查探究影响反应速率的因素,为高频考点,把握原电池、温度、浓度对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意金属的活泼性,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. |  1,3,4-三甲苯 1,3,4-三甲苯 | B. | CH3CH(Cl)CH3 2-氯丙烷 | ||
| C. | 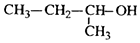 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 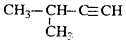 2-甲基-3-丁炔 2-甲基-3-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离出的c(H+)=10-13mol•L溶液:Na+、NH4+、CO32-、SO42- | |
| B. | 澄清透明溶液:Mg2+、Cu2+、SO42-、Cl- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014溶液:Ba2+、Na+、ClO-、NO- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
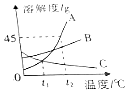 如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:
如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol•L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A. | 20~40s内,v(N2O4)=0.004mol/(L•s) | |
| B. | 在相同条件下,开始时若向容器中充入的是0.80 molNO2,达到平衡后NO2的转化率为75% | |
| C. | 反应达平衡时,吸收的热量为15.9 kJ | |
| D. | 100 s时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
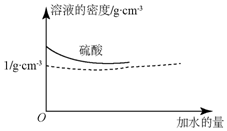 已知硫酸的密度与所加水量的关系如图所示,
已知硫酸的密度与所加水量的关系如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ② | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 试剂及其用量 | |||
| 0.2mol•L-1kJ/mL | KClO3(s)/g | 6.0mol•L-1H2SO4/mL | H2O/mL | |
| 1 | 1.0 | 0.1 | 0 | a |
| 2 | 1.0 | 0.1 | 3.0 | b |
| 3 | 1.0 | 0.1 | 6.0 | c |
| 4 | 1.0 | 0.1 | 9.0 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com